BRAFTOVI 75 mg, gélule, boîte de 42 plaquettes thermoformées de 1
Dernière révision : 14/11/2024
Taux de TVA : 2.1%
Prix de vente : 1 385,25 €
Taux remboursement SS : 100%
Base remboursement SS : 1 385,25 €
Laboratoire exploitant : PIERRE FABRE MEDICAMENT
Mélanome
L'encorafenib
en association avec le binimetinib est indiqué dans le traitement de
patients adultes atteints de mélanome non résécable ou métastatique
porteur d'une mutation BRAF V600.
Cancer colorectal (CCR)
L'encorafenib
en association avec le cetuximab, est indiqué dans le traitement de
patients adultes atteints de cancer colorectal métastatique porteur
d'une mutation BRAF V600E, ayant reçu un traitement systémique
antérieur.
Cancer bronchopulmonaire non à petites cellules (CBNPC)
L'encorafenib
en association avec le binimetinib est indiqué dans le traitement de
patients adultes atteints de cancer bronchopulmonaire non à petites
cellules avancé porteur d'une mutation BRAF V600E.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
L'encorafenib doit être utilisé en association au binimetinib (chez les patients atteints de mélanome non résécable ou métastatique porteur de la mutation BRAF V600 et chez les patients atteints d'un CBNPC avancé porteur de la mutation BRAF V600E) ou en association avec le cetuximab (chez les patients atteints d'un cancer colorectal métastatique porteur de la mutation BRAF V600E). Pour davantage d'informations sur les mises en garde et précautions associées au traitement par binimetinib ou cetuximab, voir la rubrique Mises en garde spéciales et précautions d'emploi du RCP du binimetinib ou du cetuximab.
L'encorafenib en association au binimetinib chez les patients qui ont progressé sous traitementantérieur par inhibiteur de BRAF
Il existe peu de données sur l'utilisation de l'encorafenib en association au binimetinib chez les patients ayant progressé sous un traitement antérieur par inhibiteur de BRAF administré pour le traitement du mélanome non résécable ou métastatique avec une mutation BRAF V600. Ces données indiquent que l'efficacité de l'association serait plus faible chez ces patients.
L'encorafenib en association au binimetinib chez les patients présentant des métastases cérébrales
Les données d'efficacité chez les patients avec un mélanome BRAF V600 muté ou un CBNPC porteur de la mutation BRAF V600E présentant des métastases cérébrales traités par l'encorafenib en association avec binimetinib sont limitées (voir rubrique Propriétés pharmacodynamiques).
Dysfonction ventriculaire gauche (DVG)
Une
dysfonction ventriculaire gauche définie comme une diminution symptomatique ou
asymptomatique de la fraction d'éjection ventriculaire gauche (FEVG) peut
survenir lorsque l'encorafenib est utilisé en association avec le binimetinib.
Il
est recommandé d'évaluer la FEVG par échocardiographie ou scintigraphie
myocardique (MUGA) avant l'initiation du traitement par encorafenib et
binimetinib, un mois après le début du traitement, puis à environ 3 mois
d'intervalle ou plus fréquemment au cours du traitement, si cliniquement
indiqué. En cas de survenue de DVG pendant le traitement, consultez la rubrique
Posologie et mode d'administration du RCP du binimetinib.
La
tolérance de l'encorafenib en association au binimetinib n'a pas encore été
établie chez les patients présentant une FEVG initiale inférieure à 50 %, ou
inférieure à la limite inférieure de la normale selon les valeurs de références
de l'hôpital. Par conséquent, chez ces patients, le binimetinib doit être
utilisé avec prudence et, en cas de DVG symptomatique, de diminution de la FEVG
de grade 3-4 ou de diminution d'au moins 10 % en valeur absolue de la FEVG par
rapport à la valeur initiale, le binimetinib et l'encorafenib doivent être
arrêtés et la FEVG doit être ré-évaluée toutes les 2 semaines jusqu'à
résolution.
Hémorragie
Des hémorragies, y compris des accidents hémorragiques majeurs, peuvent survenir lors de l'administration d'encorafenib (voir rubrique Effets indésirables). Le risque hémorragique peut augmenter en cas d'utilisation concomitante d'un traitement anticoagulant et antiplaquettaire. La survenue d'accidents hémorragiques de grade ≥ 3 doit être prise en charge par l'interruption de la dose ou l'arrêt du traitement (voir Tableau 4 à la rubrique Posologie et mode d'administration) et selon le tableau clinique.
Toxicités oculaires
Des
toxicités oculaires, incluant des uvéites, des iritis et des iridocyclites
peuvent survenir lors de l'administration d'encorafenib. Un décollement de
l'épithélium pigmentaire de la rétine a également été rapporté chez les patients
traités par encorafenib en association avec le binimetinib (voir rubrique Effets
indésirables).
À
chaque visite, les symptômes visuels doivent être évalués chez les patients. Si
des symptômes indiquant l'apparition ou l'aggravation de troubles visuels,
notamment une baisse de la vision centrale, une vision trouble ou une perte de
la vue, sont observés, il est recommandé de procéder rapidement à un examen
ophtalmologique.
En
cas de survenue d'une uvéite, y compris d'une iridocyclite et d'une iritis pendant
le traitement, se référer à la rubrique Posologie et mode d'administration.
Si
pendant le traitement le patient développe un décollement de l'épithélium
pigmentaire de la rétine (DEPR) ou une occlusion de la veine de la rétine
(OVR), se référer à la rubrique Posologie et mode d'administration du
RCP du binimetinib pour plus d'informations.
Allongement de l'intervalle QT
Un
allongement de l'intervalle QT a été observé chez les patients traités par des
inhibiteurs de BRAF. Il n'a pas été conduit d'étude dédiée de l'intervalle QT
visant à évaluer le potentiel d'allongement de l'intervalle QT par
l'encorafenib.
Globalement,
les résultats suggèrent que l'encorafenib administré seul est susceptible de
provoquer de légères augmentations de la fréquence cardiaque. Les résultats des
études groupées de l'encorafenib en association au binimetinib administrés aux
doses recommandées et d'une étude d'encorafenib seul, suggèrent que
l'encorafenib peut entraîner de légers allongements de l'intervalle QTc (voir rubrique
Propriétés pharmacodynamiques).
Les
données sont insuffisantes pour exclure un allongement de l'intervalle QT
cliniquement significatif dépendant de l'exposition systémique.
En
raison du risque potentiel d'allongement de l'intervalle QT, il est recommandé de
corriger les anomalies électrolytiques sériques, notamment celles du magnésium
et du potassium, de contrôler les facteurs de risque d'allongement de
l'intervalle QT (par ex., insuffisance cardiaque congestive, bradycardie) avant
le début du traitement et pendant le traitement.
Il
est recommandé de réaliser un électrocardiogramme (ECG) avant le début du
traitement par l'encorafenib, un mois après, puis à environ 3 mois d'intervalle
ou plus fréquemment au cours du traitement si cliniquement indiqué. La survenue
d'un allongement de l'intervalle QTc peut être prise en charge avec une
réduction de dose, une suspension de dose ou l'arrêt définitif du traitement
ainsi qu'une correction des anomalies électrolytiques et un contrôle des
facteurs de risque (voir rubrique Posologie et mode d'administration).
Nouvelles tumeurs primitives
De nouvelles tumeurs primitives, cutanées et non cutanées, ont été observées chez des patients traités par des inhibiteurs de BRAF et peuvent apparaître lors de l'administration de l'encorafenib (voir rubrique Effets indésirables).
Tumeurs cutanées
Des
tumeurs cutanées, telles qu'un carcinome épidermoïde cutané (CEC), incluant des
cas de kératoacanthome, ont été observées chez des patients traités par des
inhibiteurs de BRAF, dont l'encorafenib.
De
nouveaux mélanomes primitifs ont été observés chez des patients traités par des
inhibiteurs de BRAF, dont l'encorafenib (voir rubrique Effets indésirables).
Un
examen clinique dermatologique doit être effectué avant le début du traitement
par encorafenib, puis tous les 2 mois pendant le traitement et jusqu'à 6 mois
après l'arrêt de celui-ci. Les lésions suspectes de la peau doivent être
traitées par exérèse cutanée avec un examen dermato- anatomopathologique. Les
patients doivent être avertis qu'ils doivent immédiatement signaler à leurs
médecins l'apparition de toute nouvelle lésion cutanée. Le traitement par
l'encorafenib doit être poursuivi sans modifications de dose.
Tumeurs non cutanées
En
raison de son mécanisme d'action, l'encorafenib peut favoriser l'apparition de
tumeurs associées à l'activation du gène RAS via des mutations ou d'autres
mécanismes. Les patients recevant l'encorafenib doivent bénéficier d'un examen
clinique de la tête et du cou, d'un scanner thoraco- abdominal et d'un examen
de la région anale et pelvienne (pour les femmes), ainsi que d'une numération
de la formule sanguine complète avant le début, au cours et à la fin du
traitement, comme cliniquement approprié. L'arrêt définitif de l'encorafenib
doit être envisagé chez les patients qui développent des tumeurs non cutanées
avec mutation du gène RAS. Les bénéfices et risques doivent être évalués
attentivement avant d'administrer l'encorafenib aux patients ayant des
antécédents de cancer ou atteints d'un cancer évolutif associé à une mutation
du gène RAS.
Syndrome de lyse tumorale (SLT)
La survenue de SLT, qui peut être fatale, a été associée à l'utilisation d'encorafenib en association avec le binimetinib (voir rubrique Effets indésirables). Les facteurs de risque du SLT comprennent une charge tumorale élevée, une insuffisance rénale chronique préexistante, une oligurie, une déshydratation, une hypotension et une urine acide. Ces patients doivent être étroitement surveillés et traités rapidement selon les indications cliniques, et une hydratation prophylactique doit être envisagée.
Anomalies biologiques hépatiques
Les anomalies biologiques hépatiques, notamment une élévation des transaminases ASAT et ALAT ont été observées avec l'encorafenib (voir rubrique Effets indésirables). Les paramètres biologiques hépatiques doivent faire l'objet d'un contrôle avant le début du traitement par encorafenib et faire l'objet d'une surveillance au moins mensuelle pendant les 6 premiers mois de traitement, puis si cliniquement indiqué. Les anomalies biologiques hépatiques doivent être prises en charge avec une réduction de dose, une suspension de dose ou l'arrêt définitif du traitement (voir rubrique Posologie et mode d'administration).
Insuffisance hépatique
Compte
tenu du métabolisme principal de l'encorafenib et de son élimination par le
foie, les patients atteints d'une insuffisance hépatique légère à sévère
peuvent présenter une exposition accrue à l'encorafenib au-delà de la marge
d'exposition liée à la variabilité interindividuelle (voir rubrique Propriétés
pharmacocinétiques).
En
l'absence de données cliniques, l'encorafenib n'est pas recommandé chez les
patients atteints d'une insuffisance hépatique modérée ou sévère.
Encorafenib
doit être administré avec prudence à une dose de 300 mg une fois par jour chez
les patients atteints d'une insuffisance hépatique légère (voir rubrique Posologie
et mode d'administration).
Une
surveillance plus étroite des toxicités liées à l'encorafenib chez les patients
atteints d'une insuffisance hépatique légère est recommandée, notamment un
examen clinique et un bilan hépatique avec évaluations de l'ECG doit se faire
d'une manière cliniquement appropriée pendant le traitement.
Insuffisance rénale
Aucune
donnée clinique n'est disponible chez les patients présentant une insuffisance
rénale sévère (voir rubriques Posologie et mode d'administration et Propriétés
pharmacocinétiques).
L'encorafenib
doit être utilisé avec prudence chez les patients présentant une insuffisance
rénale sévère. Une augmentation de la créatinine a été fréquemment rapportée
avec l'encorafenib administré seul ou en association avec le binimetinib ou
avec le cetuximab. Les cas observés de défaillance rénale, y compris d'atteinte
rénale aiguë et d'insuffisance rénale, étaient généralement associés à des
vomissements et à une déshydratation. D'autres facteurs contributifs, incluent
diabète et hypertension artérielle. La créatinine sanguine doit être surveillée
selon le tableau clinique et l'élévation de la créatinine doit être prise en
charge avec une réduction de dose, une suspension de dose ou l'arrêt définitif
du traitement (voir Tableau 4 à la rubrique Posologie et mode
d'administration). Les patients doivent veiller à avoir une bonne
hydratation pendant le traitement.
Effets d'autres médicaments sur l'encorafenib
L'utilisation
concomitante d'inhibiteurs puissants du CYP3A pendant le traitement par
encorafenib doit être évitée. Si l'utilisation concomitante d'un inhibiteur
puissant du CYP3A est nécessaire, il convient de surveiller attentivement les
patients pour leur sécurité (voir rubrique Interactions avec d'autres
médicaments et autres formes d'interactions).
L'administration
concomitante d'un inhibiteur modéré du CYP3A et de l'encorafenib doit faire
l'objet d'une utilisation avec prudence.
Résumé du profil de sécurité
La
sécurité de l'encorafenib (450 mg par voie orale une fois par jour) en
association avec le binimetinib (45 mg par voie orale deux fois par jour) a été
évaluée dans la population de sécurité intégrée (ISP) de 372 patients incluant
des patients atteints de mélanome non résécable ou métastatique et des patients
atteints de CBNPC avancé porteurs d'une mutation BRAF V600E (ci-après dénommé
ISP Combo450).
Dans l'ISP Combo 450, 274 patients ont reçu l'association pour le traitement du
mélanome non résécable ou métastatique porteurs d'une mutation BRAF V600 (dans
deux études de phase II (CMEK162X2110 et CLGX818X2109) et une étude de phase
III (CMEK162B2301, partie 1) et 98 patients ont reçu l'association pour le
traitement du CBNPC avancé porteur d'une mutation BRAF V600E (dans une étude de
phase II non randomisée (ARRAY-818-202)) (voir rubrique Propriétés
pharmacodynamiques).
Les effets indésirables les plus fréquents (≥ 25 %) observés chez les
patients traités par l'encorafenib en association à le binimetinib ont été :
fatigue, nausées, diarrhée, vomissements, douleurs abdominales, myopathies /
troubles musculaires et arthralgies.
La
sécurité de l'encorafenib (300 mg pris oralement une fois par jour) en
association avec du binimetinib (45 mg pris oralement deux fois par jour) a été
évaluée chez 257 patients atteints d'un mélanome métastatique ou non non
résécable porteur d'une mutation BRAF V600 (ci-après dénommés la population
Enco 300), basée sur l'étude de phase III (CMEK162B2301, Partie 2).
Les effets indésirables les plus fréquents (≥ 25 %) observes chez les
patients traités à 300 mg d'encorafenib administrés avec du binimetinib étaient
la fatigue, la nausée et la diarrhée.
Le profil de sécurité de l'encorafenib en monothérapie (300 mg oralement une fois par jour) repose sur les données provenant de 217 patients atteints d'un mélanome métastatique ou non résécable porteur d'une mutation BRAF V600 (ci-après désignées comme l'ensemble de la population Enco 300). Les effets indésirables les plus fréquents (≥ 25 %) rapportés avec l'encorafenib 300 étaient les suivants : hyperkératose, alopécie, érythrodysesthésie palmo-plantaire, fatigue, rash, arthralgies, sécheresse cutanée, nausées, myalgies, céphalées, vomissements et prurit.
La
sécurité de l'encorafenib (300 mg pris oralement une fois par jour) en
association au cetuximab (dosé conformément à son RCP) a été évaluée chez 216
patients atteints de cancer colorectal métastatique porteur d'une mutation BRAF
V600E, sur la base de l'étude de phase III ARRAY-818-302. Les effets
indésirables les plus fréquents (> 25 %) rapportés dans cette population
étaient les suivants : fatigue, nausées, diarrhée, dermatite acnéiforme,
douleur abdominale, arthralgies/douleur musculosquelettique, baisse de
l'appétit, rash et vomissement.
Le taux d'arrêt de tous les médicaments de l'étude dû à un effet indésirable
était de 1,9 % chez les patients traités par encorafenib 300 mg en association
au cetuximab.
Liste des effets indésirables sous forme de tableau
Les
effets indésirables sont énumérés ci-dessous selon les classes de systèmes
d'organes MedDRA et les conventions de fréquence suivantes : très fréquent (≥1/10),
fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à <
1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000),
fréquence indéterminée (ne peut être estimée sur la base des données
disponibles).
Pour chaque catégorie de fréquence, les effets indésirables sont présentés en
ordre décroissant de sévérité.
Tableau 5 : Effets indésirables
| Fréquence |
Encorafenib
en monothérapie 300 mg (n = 217) |
Encorafenib
450 mg en association au binimetinib (n = 372) |
Encorafenib
300 mg en association au cetuximab (n = 216) |
| Tumeurs bénignes, malignes et non précisées | |||
| Très fréquent |
Papillome
cutané* Nævus mélanocytaire |
Nævus mélanocytaire | |
| Fréquent |
CEC
a Nouveau mélanome primitif* |
CECa
Papillome cutané* |
CECa
Papillome cutané* Nouveau mélanome primitif* |
| Peu fréquent | Carcinome basocellulaire | Carcinome basocellulaire* | Carcinome basocellulaire* |
| Affections hématologiques et du système lymphatique | |||
| Très fréquent | Anémie | ||
| Affections du système immunitaire | |||
| Fréquent | Hypersensibilitéb | Hypersensibilitéb | Hypersensibilitéb |
| Troubles du métabolisme et de la nutrition | |||
| Très fréquent | Baisse de l'appétit | Baisse de l'appétit | |
| Indéterminée | Syndrome de lyse tumorale | ||
| Affections psychiatriques | |||
| Très fréquent | Insomnie | Insomnie | |
| Affections du système nerveux | |||
| Très fréquent |
Céphalée*
Neuropathie périphérique* Dysgueusie* |
Neuropathie
périphérique* Sensation vertigineuse* Céphalée* |
Neuropathie
périphérique* Céphalée* |
| Fréquent | Parésie faciale c | Dysgueusie* |
Sensation
vertigineuse* Dysgueusie |
| Peu fréquent | Parésie faciale c | ||
| Affections oculaires | |||
| Très fréquent |
Trouble
visuel* Décollement de l'épithélium pigmentaire de la rétine (DEPR)* |
||
| Fréquent | Uvéite* | ||
| Peu fréquent | Uvéite* | ||
| Affections cardiaques | |||
| Fréquent | Tachycardie supraventriculaire d | DVGh | Tachycardie supraventriculaire d |
| Affections vasculaires | |||
| Très fréquent |
|
Hémorragiei
Hypertension* |
Hémorragiei |
| Fréquent |
|
Maladie thromboembolique veineuse j |
|
| Affections gastro-intestinales | |||
| Très fréquent |
Nausée
Vomissement* Constipation |
Nausée
Vomissement* Constipation Douleur abdominale* Diarrhée* |
Nausées
Vomissement* Constipation Douleur abdominale* Diarrhée* |
| Fréquent |
|
Colitek |
|
| Peu fréquent | Pancréatite* | Pancréatite* | Pancréatite* |
| Affections de la peau et du tissu sous-cutané | |||
| Très fréquent |
Érythrodysesthésie
palmo-plantaire (EPP) Hyperkératose* Rash* Sécheresse cutanée* Prurit* Alopécie* Érythèmee Hyperpigmentation cutanée* |
Hyperkératose*
Rash* Sécheresse cutanée* Prurit* Alopécie* |
Dermatite
acnéiforme* Rash* Sécheresse cutanée* Prurit* |
| Fréquent |
Dermatite
acnéiforme* Exfoliation cutanéef Photosensibilité* |
Dermatite
acnéiforme* Érythrodysesthésie palmo-plantaire (EPP) Érythème* Panniculite* Photosensibilité* |
Hyperpigmentation
cutanée Érythrodysesthésie palmo-plantaire (EPP) Hyperkératose* Alopécie Érythèmee |
| Peu fréquent |
|
|
Exfoliation cutanéef |
| Affections musculo-squelettiques et systémiques | |||
| Très fréquent |
Arthralgie*
Myalgie g Douleur aux extrémités Dorsalgie |
Arthralgie*
Myopathie/Troubles musculaires1 Douleur aux extrémités Dorsalgie* |
Arthralgies/douleur
musculosquelettique* Myopathie/trouble musculaire* Douleurs aux extrémités Dorsalgie |
| Fréquent | Arthrite* |
|
|
| Peu fréquent |
|
Rhabdomyolyse |
|
| Affections du rein et des voies urinaires | |||
| Fréquent | Insuffisance rénale* | Insuffisance rénale* | Insuffisance rénale* |
| Troubles généraux et anomalies au site d'administration |
|
|
|
| Très fréquent |
Fatigue*
Fièvre* |
Fatigue*
Fièvre* Œdème périphérique m |
Fatigue*
Fièvre* |
| Investigations | |||
| Très fréquent | Gamma-glutamyltransférase (GGT) augmentée* |
Créatine
phosphokinase sanguine augmentée Gamma-glutamyltransférase (GGT) augmentée* Transaminase augmentée* |
|
| Fréquent |
Transaminase
augmentée* Créatinine sanguine augmentée* Lipase augmentée |
Phosphatase
alcaline sanguine augmentée Créatinine sanguine augmentée* Amylase augmentée Lipase augmentée |
Créatinine
sanguine augmentée* Transaminase augmentée* |
| Peu fréquent | Amylase augmentée |
|
Amylase
augmentée Lipase augmentée |
*
Noms composés qui comprenaient plusieurs Termes Préférés
a Comprend notamment, kératoacanthome, carcinome épidermoïde et carcinome épidermoïde de la peau
b Comprend, notamment, œdème de Quincke, hypersensibilité médicamenteuse, hypersensibilité, vascularite allergique, et urticaire
c Comprend trouble lié au nerf facial, paralysie faciale, parésie faciale, paralysie de Bell
d Comprend, sans s'y limiter, extrasystoles et tachycardie sinusale
e Comprend érythème, érythème généralisé, érythème plantaire
f Comprend dermatite exfoliatrice, exfoliation cutanée, rash avec exfoliation
g Comprend myalgies, fatigue musculaire, lésions musculaires, spasme musculaire, fatigue musculaire
h Comprend dysfonction ventriculaire gauche, fraction d'éjection diminuée, insuffisance cardiaque et fraction d'éjection anormale
i Comprend les hémorragies à différents sites, notamment, hémorragies cérébrales, hémorragies intracrâniennes, hémorragies vaginales, saignements menstruels abondants, saignements intermenstruels, hématochézie, hémoptysie, hémothorax, hémorragies gastro-intestinales et hématurie j Comprend, notamment, embolie pulmonaire, thrombose veineuse profonde, l'embolie, thrombophlébite, thrombophlébite superficielle, thrombose, phlébite, syndrome de la veine cave supérieure, thrombose de la veine mésentérique et thrombose de la veine cave.
k Comprend colite, colite ulcéreuse, entérocolite et proctite
l Comprend myalgie, faiblesse musculaire, spasme musculaire, lésions musculaires, myopathie, myosite
m Comprend, notamment, rétention hydrique, œdème périphérique, œdème localisé, œdème généralisé et enflure.
a Comprend notamment, kératoacanthome, carcinome épidermoïde et carcinome épidermoïde de la peau
b Comprend, notamment, œdème de Quincke, hypersensibilité médicamenteuse, hypersensibilité, vascularite allergique, et urticaire
c Comprend trouble lié au nerf facial, paralysie faciale, parésie faciale, paralysie de Bell
d Comprend, sans s'y limiter, extrasystoles et tachycardie sinusale
e Comprend érythème, érythème généralisé, érythème plantaire
f Comprend dermatite exfoliatrice, exfoliation cutanée, rash avec exfoliation
g Comprend myalgies, fatigue musculaire, lésions musculaires, spasme musculaire, fatigue musculaire
h Comprend dysfonction ventriculaire gauche, fraction d'éjection diminuée, insuffisance cardiaque et fraction d'éjection anormale
i Comprend les hémorragies à différents sites, notamment, hémorragies cérébrales, hémorragies intracrâniennes, hémorragies vaginales, saignements menstruels abondants, saignements intermenstruels, hématochézie, hémoptysie, hémothorax, hémorragies gastro-intestinales et hématurie j Comprend, notamment, embolie pulmonaire, thrombose veineuse profonde, l'embolie, thrombophlébite, thrombophlébite superficielle, thrombose, phlébite, syndrome de la veine cave supérieure, thrombose de la veine mésentérique et thrombose de la veine cave.
k Comprend colite, colite ulcéreuse, entérocolite et proctite
l Comprend myalgie, faiblesse musculaire, spasme musculaire, lésions musculaires, myopathie, myosite
m Comprend, notamment, rétention hydrique, œdème périphérique, œdème localisé, œdème généralisé et enflure.
Lorsque l'encorafenib était administré à une dose de 300 mg une fois par jour en association avec 45 mg de binimetinib deux fois par jour (Combo 300) dans l'étude CMEK162B2301-Partie 2, la catégorie de fréquence des effets indésirables était inférieure comparée à l'ensemble de la population Combo 450 pour les effets indésirables suivants : anémie, neuropathie périphérique, hémorragie, hypertension, prurit (commun) ; et colite, amylase accrue et lipase accrue (peu commun).
Description de certains effets indésirables
Tumeurs cutanées
Carcinome épidermoïde cutané (CEC)
Mélanome
et CBNPC
Dans
l'ISP Combo450, des CEC, y compris les kératoacanthomes, ont été observés chez
3,0 % des patients (11/372). Le délai médian de survenue du premier événement
de CEC (tous grades confondus) était de 6,5 mois (allant de 1,0 à 22,8 mois).
Dans l'ensemble de la population Enco 300, des CEC ont été rapportés chez 7,4 % des patients (16/217). Pour les patients de l'étude de phase III (CMEK162B2301) qui ont développé un CEC, le délai médian de survenue du premier événement de CEC (tous grades confondus) était de 2,3 mois (allant de 0,3 à 12,0 mois).
Cancer
colorectal
Chez
les patients traités par encorafenib 300 mg en association au cetuximab, des CEC,
y compris les kératoacanthomes, ont été observés chez 1,4 % des patients
(3/216). Les délais de survenue du premier événement de CEC (tous grades
confondus) étaient de 0,5, 0,6 et 3,6 mois pour ces 3 patients.
Nouveau mélanome primitif
Mélanome
Dans
l'ensemble de la population Enco 300, des événements de nouveaux mélanomes
primitifs se sont produits chez 4,1 % des patients (9/217) et ont été déclarés
comme étant de grade 1 chez 1,4 % des patients (3/217), de grade 2 chez 2,1 %
des patients (4/217), de grade 3 chez 0,5 % des patients et de grade 4 chez 0,5
% des patients.
Cancer
colorectal
Chez
les patients traités par encorafenib 300 mg en association au cetuximab, des
événements de nouveaux mélanomes primitifs se sont produits chez 1,9 % des
patients (4/216) et ont été déclarés comme étant de grade 2 chez 0,9 % des
patients (2/216) et de grade 3 chez 0,9 % des patients (2/216).
Atteintes oculaires
Mélanome et CBNPC
Dans
l'ISP Combo450, une uvéite a été rapportée chez 3,5 % des patients (13/372).
Elle était de grade 1 chez 0,5 % des patients (2/372), de grade 2 chez 2,7 %
(10/372) et de grade 3 chez 0,3 % (1/372). Des troubles visuels, y compris une
vision trouble et une baisse de l'acuité visuelle, sont survenus chez23,1 % des
patients (86/372). L'uvéite et les défauts visuels se sont généralement avérés
réversibles.
Un
décollement de l'épithélium pigmentaire de la rétine a été relevé chez22 ,3 %
(83/372) des patients, de grade 1 ou 2 pour la plupart, tandis que 1,6 %
(6/372) d'entre eux manifestaient des événements de grade 3.
Au cours de l'étude CMEK162B2301-Partie 2, dans le bras Combo 30, un décollement de l'épithélium pigmentaire de la rétine a été observé chez 12,5 % (32/257) des patients dont 0,4 % (1/257) manifestaient des événements de grade 4.
Dysfonction ventriculaire gauche
Une
DVG a été rapporté lorsque l'encorafenib était utilisé en association au
binimetinib chez les patients atteints de mélanome et CBNPC (voir rubrique Effets
indésirables du RCP du binimetinib).
Hémorragie
Mélanome et CBNPC
Des
événements hémorragiques ont été observés chez16,7 % des patients (62/372) dans
l'ISP Combo450. La plupart des événements étaient des événements de grade 1 ou
2 : 13,2 % (49/372) et 3,5 % (13/372) étaient de grade > 3-4. Peu de
patients ont nécessité des interruptions ou des réductions de dose (2,4 %, soit
9/372). Les événements hémorragiques ont conduit à l'arrêt du traitement chez
0,8% des patients (3/372). Les événements hémorragiques les plus fréquents
étaient hématurie chez 2,7 % des patients (10/372), hématochézie chez 2,7%
(10/372) et rectorragie chez 2,2 % des patients (8/372). Une hémorragie fatale
due à un ulcère gastrique avec une défaillance multiviscérale comme cause
simultanée de décès a été rapportée chez un patient.
Une
hémorragie cérébrale / hémorragie intracrânienne a été rapportée chez 1,3 % des
patients (5/372), d'évolution fatale chez 4 patients. Tous les événements sont
survenus dans le contexte de nouvelles métastases cérébrales ou de métastases
cérébrales évolutives.
Dans l'étude CMEK162B2301-Partie 2, dans le bras Combo 300, des événements hémorragiques ont été observés chez 6,6 % (17/257) des patients et étaient de grade 3-4 chez 1,6 % (4/257) des patients.
Cancer colorectal
Des
événements hémorragiques ont été observés chez 21,3 % des patients (46/216)
traités par encorafenib 300 mg en association au cetuximab ; 1,4 % des
événements (3/216) étaient de grade 3 et un cas fatal a été rapporté. Des
interruptions ou des réductions de dose ont été nécessaires chez 1,9 % des
patients (4/216). Les événements hémorragiques ont conduit à l'arrêt du
traitement chez 1 patient (0,5 %).
Les
événements hémorragiques les plus fréquents étaient une épistaxis chez 6,9 %
des patients (15/216), une hématochézie chez 2,8 % des patients (6/216), une
rectorragie chez 2,8 % des patients (6/216) et une hématurie chez 2,8 % des
patients (6/216).
Hypertension
L'hypertension
a été rapportée lorsque l'encorafenib était utilisé en association au
binimetinib chez les patients atteints de mélanome et CBNPC (voir rubrique Effets
indésirables du RCP du binimetinib).
Maladie thromboembolique veineuse
Une
maladie thromboembolique veineuse (MTEV) a été rapportée lorsque l'encorafenib
était utilisé en association au binimetinib chez les patients atteints de
mélanome et CBNPC (voir rubrique Effets indésirables du RCP du
binimetinib).
Pancréatite
Mélanome et CBNPC
Dans
l'ISP Combo450, une augmentation des enzymes pancréatiques, généralement
asymptomatique, a été rapportée. Des augmentations de l'amylase et de la lipase
ont été rapportées, respectivement, chez 4,0 % (15/372) et 7,8 % (29/372) des
patients. Une pancréatite a été rapportée chez 0,8 % des patients (3/372). Chez
ces trois patients, il s'agissait d'événements de grade 3. La pancréatite a
conduit à l'interruption de la dose chez 0,3 % des patients (1/372).
Cancer colorectal
Dans
la population traitée par encorafenib 300 mg en association au cetuximab, une
pancréatite de grade 3 avec événements de lipase et amylase augmentées a été
rapportée chez 1 patient (0,5 %) et a conduit à l'interruption de la dose.
Réactions cutanées
Rash
Mélanome
et CBNPC
Dans
l'ISP Combo450, un rash est survenu chez 20,4 % des patients (76/372). La
plupart des événements étaient sans sévérité, avec des événements de grade 3 ou
4 rapportés chez 1,1 % des patients (4/372). Le rash a conduit à l'arrêt
définitif du traitement chez 0,8 % des patients (3/372) et à une interruption
ou une modification de la dose chez 2,4 % des patients (9/372).
Dans l'ensemble de la population Enco 300, un rash a été rapporté chez 43,3 % des patients (94/217). La plupart des événements étaient sans sévérité, avec des événements de grade 3 ou 4 rapportés chez 4,6 % des patients (10/217). Le rash a conduit à l'arrêt définitif du traitement chez 0,5 % des patients (1/217) et à une interruption ou une modification de la dose chez 7,4 % des patients (16/217).
Cancer
colorectal
Chez
les patients traités par encorafenib 300 mg en association au cetuximab, un
rash est survenu chez 30,6 % des patients (66/216). La plupart des événements
étaient sans sévérité, un événement de grade 3 ayant été rapporté chez 0,5 %
des patients (1/216). Le rash a conduit à une interruption de la dose chez 0,5
% des patients (1/216).
Érythrodysesthésie palmo-plantaire
Mélanome
et CBNPC
Dans
l'ISP Combo450, une érythrodysesthésie palmo-plantaire a été rapportée chez 5,1
% des patients (19/372). Tous les effets de type érythrodysesthésie
palmo-plantaire étaient soit de grade 1 (2,7 %), soit de grade 2 (2,4 %). Une
interruption ou une modification de la dose a eu lieu chez 1,1 % des patients
(4/372).
Dans le bras Combo 300 de la partie 2 de l'étude pivot, l'érythrodysesthésie palmo-plantaire a été observée chez 3,9 % (10/257) des patients et était de grade 3 chez 0,4 % (1/257) des patients.
Dans l'ensemble de la population Enco 300, une érythrodysesthésie palmo-plantaire a été rapportée chez 51,6 % des patients (112/217). La plupart des événements étaient légers à modérés : de grade 1 chez 12,4 % des patients (27/217), de grade 2 chez 26,7 % (58/217) et de grade 3 chez 12,4 % des patients (27/217). L'érythrodysesthésie palmo-plantaire a conduit à l'arrêt définitif du traitement chez 4,1 % des patients (9/217) et à une interruption ou une modification de la dose chez 23,0 % des patients (50/217).
Cancer
colorectal
Dans
la population traitée par encorafenib 300 mg en association au cetuximab, une
érythrodysesthésie palmo-plantaire a été rapportée chez 5,1 % des patients
(11/216). La plupart des effets de type érythrodysesthésie palmo-plantaire étaient
de grade 1 chez 3,7 % des patients (8/216). Des événements de grade 2 ont été
rapportés chez 0,9 % des patients (2/216) et de grade 3 chez 0,5 % des patients
(1/216). Aucune interruption de la dose, modification de la dose ni aucun arrêt
définitif du traitement n'a été nécessaire.
Dermatite acnéiforme
Mélanome
et CBNPC
La
dermatite acnéiforme a été rapportée lorsque l'encorafenib était utilisé en
association au binimetinib (voir la rubrique Effets indésirables du RCP
du binimetinib).
Cancer
colorectal
Chez
les patients traités par encorafenib 300 mg en association au cetuximab, une
dermatite acnéiforme a été rapportée chez 33,3 % des patients (72/216) et
était, dans la plupart des cas, de grade 1 (25,5 % des patients (55/216)), ou
de grade 2 (6,9 % des patients (15/216)). Une réduction ou une interruption de
la dose a été rapportée chez 2,3 % des patients (5/216). Aucun arrêt définitif
du traitement n'a été rapporté. La dermatite acnéiforme était généralement
réversible.
Photosensibilité
Mélanome
et CBNPC
Dans
l'ISP Combo450, une photosensibilité a été observée chez 4,3 % des patients
(16/372). La plupart des événements étaient de grade 1 à 2, et de grade 3 chez
0,3 % des patients (1/372) et aucun événement n'a conduit à un arrêt définitif
du traitement. Une interruption ou une modification de la dose a été rapportée
chez 0,3 % des patients (1/372).
Dans l'ensemble de la population Enco 300, la photosensibilité a été observée chez 4,1 % des patients (9/217). La plupart des événements étaient de grade 1 à 2. Aucun événement n'a requis d'arrêt définitif, de modification ou d'interruption de la dose.
Parésie faciale
Mélanome
et CBNPC
Dans
l'ISP Combo450, la parésie faciale a été observée chez0,8 % des patients
(3/372), dont des événements de grade 3 chez 0,3 % (1/372) des patients. Les
événements étaient réversibles et aucun n'a entraîné l'arrêt définitif du
traitement. Une interruption ou une modification de la dose a été rapportée
chez 0,3 % des patients (1/372).
Dans
l'ensemble de la population Enco 300, la parésie faciale a été observée chez
7,4 % des patients (16/217). La plupart des événements étaient légers à modérés
: de grade 1 chez 2,3 % des patients (5/217), de grade 2 chez 3,7 % des
patients (8/217) et de grade 3 chez 1,4 % des patients (3/217).
Le
délai médian de survenue de la parésie faciale était de 0,3 mois (de 0,1 à 12,1
mois). La parésie faciale était généralement réversible et a mené à un arrêt
définitif du traitement chez 0,9 % des patients (2/217). Une interruption ou
une modification de la dose a été observée chez 3,7 % des patients (8/217) et
le traitement symptomatique dont les corticostéroïdes a été observé chez 5,1 %
des patients (11/217).
Élévation de la CPK et rhabdomyolyse
Une
élévation de la CPK et une rhabdomyolyse sont survenues lorsque l'encorafenib
était utilisé en association au binimetinib chez les patients atteints de
mélanome et CBNPC (voir la rubrique Effets indésirables du RCP du
binimetinib).
Insuffisance rénale
Mélanome et CBNPC
Dans
l'ISP Combo450, une augmentation de la créatinine sanguine notamment légère et
asymptomatique, de grade 1, a été observée chez 9,4 % (35/372) des patients du
bras Combo450. La fréquence d'une hausse de grade 3 ou 4 était de 0,8 %
(3/372). Des événements à type d'atteinte rénale, dont atteinte rénale aiguë et
insuffisance rénale, ont été signalés chez 3,5 % (13/372) des patients traités
par l'encorafenib et le binimetinib avec des événements de grade 3 ou 4 chez
1,9 % des patients (7/372). L'insuffisance rénale était, de façon générale,
réversible avec une interruption de la dose, une réhydratation et d'autres
mesures générales à visée symptomatique.
Cancer colorectal
Une
augmentation de la créatinine sanguine a été rapportée chez 2,8 % des patients
(6/216) traités par encorafenib 300 mg en association au cetuximab. Tous les
événements étaient sans sévérité, à l'exception d'un événement de grade 4. Des
événements de type d'insuffisance rénale étaient de grade 3 ou 4 et ont été
rapportés comme une atteinte rénale aiguë chez 1,9 % des patients (4/216) et
comme une insuffisance rénale chez 0,5 % des patients (1/216).
Anomalies biologiques hépatiques
Mélanome et CBNPC
L'incidence
des anomalies biologiques hépatiques rapportées dans l'ISP Combo450 est
indiquée ci- dessous :
- Augmentation des transaminases. 16,4 % (61/372) tous grades confondus - Grade 3 : 6,5 % (24/372)
- Augmentation des GGT : 11,3 % (42/372) tous grades confondus - Grade 3: 6,7 % (25/372)
Dans l'étude CMEK162B2301-Partie 2, dans le bras Combo 300, l'incidence d'anomalies biologiques hépatiques était comme suit :
- Augmentation des transaminases : 13,2 % (34/257) tous grades confondus - : 5,4 % (14/257) Grade 3-4
- Augmentation des GGT : 14,0 % (36/257) tous grades confondus - 4,7 % (12/257) Grade 3-4
Cancer colorectal
L'incidence
de l'augmentation des transaminases chez les patients traités par encorafenib
300 mg en association au cetuximab était de 8,8 % des patients (19/216), avec
des événements de grade 3 chez 1,4 % des patients (3/216).
Affections gastro-intestinales
Mélanome et CBNPC
Dans
l'ISP Combo 450, une diarrhée a été rapportée chez 41,7 % des patients
(155/372) et était de grade 3/4 chez 3,8 % des patients (14/372). La diarrhée a
conduit à l'arrêt définitif du traitement chez 0,8 % des patients et à une
interruption ou une modification de la dose chez 8,1 % des patients.
Une
constipation de grade 1 ou 2 est survenue chez 24,7 % des patients (92/372).
Une douleur abdominale a été rapportée chez 28,5 % des patients (106/372) et
était de grade 3 chez 2,2 % des patients (8/372). Des nausées sont survenues
chez 46,0 % des patients (171/372114/274) avec un grade 3 observé chez 3,0 %
des patients (11/372). Des vomissements sont survenus chez 31,2 % des patients
(116/372) avec un grade 3 rapporté chez 1,9 % des patients (7/372).
Dans l'étude CMEK162B2301-Part 2, dans le bras Combo 300, la nausée a été observée chez 27,2 % (70/257) des patients et était de grade 3 chez 1,6 % (4/257) des patients. Des vomissements ont été observés chez 15,2 % (39/257) des patients et étaient de grade 3 chez 0,4 % (1/257) des patients. Une diarrhée est survenue chez 28,4 % (73/257) des patients et était de grade 3 chez 1,6 % (4/257) des patients.
Cancer colorectal
Chez
les patients traités par encorafenib 300 mg en association au cetuximab, une
diarrhée a été rapportée chez 38,4 % des patients (83/216) et était de grade 3
chez 2,8 % des patients (6/216). La diarrhée a conduit à l'arrêt définitif du
traitement chez 0,5 % des patients (1/216) et à une interruption ou une
modification de la dose chez 3,7 % des patients (8/216).
Une douleur abdominale a été rapportée chez 36,6 % des patients (79/216) et était de grade 3 chez 5,1 % des patients (11/216). Des nausées sont survenues chez 38 % des patients (82/216) avec un grade 3 observé chez 0,5 % des patients (1/216). Des vomissements sont survenus chez 27,3 % des patients (59/216) avec un grade 3 rapporté chez 1,4 % des patients (3/216). Une constipation de grade 1 ou 2 est survenue chez 18,1 % des patients (39/216).
Les affections gastro-intestinales ont généralement été traitées selon les thérapies usuelles.
Anémie
Mélanome et CBNPC
Dans
l'ISP Combo 450, une anémie a été rapportée chez 23,1 % des patients (86/372) ;
7,0 % des patients (26/372) ont présenté des événements de grade 3 ou 4.
L'anémie n'a pas entraîné d'arrêt du traitement et a nécessité une interruption
ou une modification de dose chez 3,2 % des patients (12/372).
Dans l'étude CMEK162B2301-Partie 2, dans le bras Combo 300, anémie était observée chez 9,7 % (25/257) des patients et était de grade 3-4 chez 2,7 % (7/257) des patients.
Céphalée
Mélanome et CBNPC
Dans
l'ISP Combo 450, une céphalée s'est produite chez 18,8 % (70/372) des patients
et était de grade 3 chez 1,1 % (4/372) des patients.
Dans l'étude CMEK162B2301-Partie 2, dans le bras Combo 300, une céphalée a été signalée chez 12,1 % (31/257) des patients et était de grade 3 chez 0,4 % (1/257) des patients.
Cancer colorectal
Chez
les patients traités par encorafenib 300 mg en association au cetuximab, une
céphalée s'est produite chez 20,4 % des patients (44/216) et était de grade 1
ou 2.
Fatigue
Mélanome et CBNPC
Dans
l'ISP Combo 450, la fatigue a été rapportée par 48,1 % (179/372) des patients
dont 4,3 % (16/372) ont signalé une fatigue de grade 3.
Dans l'étude CMEK162B2301-Partie 2, dans le bras Combo 300, la fatigue a été observée chez 33,5 % (86/257) des patients dont 1,6 % (4/257) a rapporté une fatigue de grade 3-4.
Cancer colorectal
Chez
les patients traités par encorafenib 300 mg en association au cetuximab, la
fatigue a été rapportée chez 56,9 % des patients (123/216), dont 7,9 % (17/216)
ont signalé une fatigue de grade 3.
Populations spéciales
Personnes âgées
Mélanome et CBNPC
Parmi
l'ISP Combo450 (n =372), 230 patients (61,8 %) étaient âgés de moins de 65 ans,
107 patients (28,8 %) étaient âgés de 65 à 74 ans et 35 patients (9,4 %)
étaient âgés de plus de 75 ans. De manière globale, aucune différence quant à
la sécurité ou à l'efficacité du produit n'a été mise en évidence entre les
personnes âgées (≥ 65 ans) et les patients plus jeunes. à l'exception de
la diarrhée et du prurit qui ont été plus fréquemment rapportés chez les
patients âgés.
Dans
le sous-groupe de patients âgés de ≥ 75 ans, des effets indésirables de
grade ≥ 3 (62,9 % versus 47,5 %), des effets indésirables (tous les
grades) nécessitant une modification de la dose d'un médicament à l'étude (60 %
versus 48,1 %) ou conduisant à l'arrêt du traitement (25,7 % versus 7,4 %) ont
été plus fréquemment rapportés que chez les patients âgés de < 75 ans. Les
effets indésirables les plus fréquemment rapportés avec une incidence plus
élevée chez les patients âgés de ≥ 75 ans par rapport aux patients âgés
de < 75 ans comprenaient la fatigue, les nausées, la diarrhée, les vomissements
et l'anémie.
Cancer colorectal
Parmi
les patients traités par encorafenib 300 mg en association au cetuximab (n =
216), 134 patients (62 %) étaient âgés de moins de 65 ans, 62 patients (28,7 %)
étaient âgés de 65 à 74 ans et 20 patients (9,3 %) étaient âgés de 75 ans et
plus. Les évènements indésirables les plus fréquents rapportés avec une
incidence plus élevée chez les patients âgés de 65 ans ou plus comparés aux
patients âgés de moins de 65 ans comprenaient :vomissements, douleurs aux
extrémités et sensations vertigineuses.
Dans la population atteinte de cancer colorectal, étant donné le très faible nombre de patients traités dans le sous-groupe d'âge 75 ans et plus, les différences d'incidence des événements indésirables entre ce groupe et le groupe de patients âgés de moins de 75 ans n'ont pu être évaluées.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration voir Annexe V.
CONFIRMER
avant traitement par un
test validé que
le patient est porteur de la mutation BRAF V600E évalué par un
dispositif médical de diagnostic in vitro (IVD) marqué CE et destiné à
l'usage prévu. Si le DIV marqué CE n'est pas disponible, un autre test
validé doit être utilisé.
L'efficacité et la sécurité de l'encorafenib ont été
établies uniquement chez les patients atteints d'un mélanome porteur des
mutations BRAF V600E et V600K, ou atteints d'un CBNPC porteur d'une mutation
BRAF V600E. L'encorafenib ne doit pas être utilisé chez les patients atteints
d'un mélanome ou d'un CBNPC ou d'un CRC ayant un statut BRAF de type sauvage.
SURVEILLANCE du traitement :
- Evaluer la fraction d'éjection ventriculaire gauche par échocardiographie ou
scintigraphie myocardique avant d'initier le binimetinib, un mois après le
début du traitement, puis tous les 3 mois environ ou plus fréquemment au cours
du traitement si cliniquement indiqué.
- A chaque
visite, contrôler les symptômes visuels du patient.
-
Réaliser un électrocardiogramme avant le début du traitement par l'encorafenib,
un mois après, puis tous les 3 mois environ ou plus fréquemment au cours du
traitement si cliniquement indiqué.
- Faire un examen clinique dermatologique avant le
début du traitement, tous les 2 mois pendant le traitement et
jusqu'à 6 mois maximum après l'arrêt de celui-ci. Les lésions suspectes de la
peau doivent être traitées par exérèse cutanée avec un examen
dermato-anatomopathologique.
- Faire un examen clinique de la tête et du cou, un scanner thoraco-abdominal
et un examen de la région anale et pelvienne (pour les femmes) et une
numération de la formule sanguine complète avant le début, au cours et à la fin
du traitement, comme cliniquement approprié.
- Mesurer
les paramètres biologiques hépatiques avant le début du traitement,
mensuellement pendant les 6 premiers mois de traitement, puis si
cliniquement indiqué.
INFORMEZ
IMMEDIATEMENT un MEDECIN en cas de :
- Sensation
de vertige, de fatigue ou d'étourdissement, essoufflement, impression
que le cœur bat très fort, rapidement ou irrégulièrement, gonflement des jambes.
- Vision
trouble, perte de la vision ou autres changements de la vision (par ex. points
colorés dans la vision), halo (voir un contour flou autour des objets), douleur, œdème ou rougeur
oculaires.
- Maux de
tête, vertiges ou faiblesse, toux avec crachats de filets de sang ou des
caillots de sang, vomi contenant du sang ou qui ressemble à du « marc de café
», selles rouges ou noires qui ressemblent à du goudron, présence de sang dans
l'urine, douleur à l'estomac (abdominale), saignement vaginal inhabituel.
- Douleurs,
crampes, raideurs ou spasmes musculaires, urine foncée.
- Modifications de la peau : nouvelle verrue, peau irritée ou
grosseur rougeâtre qui saigne ou ne cicatrise pas ou changement de taille ou de
couleur d'un grain de beauté.
- Nausées, essoufflement, rythme cardiaque irrégulier, crampes
musculaires, convulsions, trouble des urines, diminution de la
production d'urine et fatigue.
OUBLI d'une dose : la dose d'encorafenib ne doit pas être prise s'il reste moins de 12 heures avant la prise de la prochaine dose prévue.
VOMISSEMENT : en cas de vomissement peu après la prise du comprimé le patient ne doit pas prendre de dose supplémentaire et prendra la prochaine dose comme initialement prévu.
MAINTENIR une bonne hydratation pendant le traitement.
PRUDENCE en cas de consommation de millepertuis (Hypericum perforatum).
NE PAS boire de jus de pamplemousse pendant le traitement.
NE PAS CONDUIRE DE VEHICULES OU UTILISER DE MACHINES en cas de troubles de la vision ou de tout autre effet indésirable qui pourrait nuire à leur aptitude à conduire des véhicules ou à utiliser des machines.
Femmes en âge de procréer/Contraception chez les femmes
Les femmes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par encorafenib et pendant au moins 1 mois après la dernière dose. L'encorafenib peut réduire l'efficacité des contraceptifs hormonaux (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). Par conséquent, il est conseillé aux patientes qui ont recours à une contraception hormonale d'utiliser une méthode alternative ou supplémentaire telles qu'une méthode barrière (un préservatif, par exemple) pendant le traitement par encorafenib et pendant au moins 1 mois après la dernière dose.
Grossesse
Il n'existe pas de données sur l'utilisation de l'encorafenib chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (voir rubrique Données de sécurité préclinique). L'encorafenib n'est pas recommandé pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception. Si l'encorafenib est utilisé pendant la grossesse ou si une grossesse survient pendant le traitement, la patiente devra être informée du danger potentiel pour le fœtus.
Allaitement
On ne sait pas si l'encorafenib ou ses métabolites sont excrétés dans le lait maternel. Un risque pour les nouveau-nés/nourrissons allaités ne peut être exclu. Une décision doit être prise soit d'interrompre l'allaitement soit d'interrompre le traitement avec encorafenib en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la mère.
Fertilité
Il n'existe pas de donnée sur les effets de l'encorafenib sur la fertilité chez les humains. Selon les résultats obtenus chez les animaux, l'utilisation d'encorafenib pourrait avoir un effet sur la fertilité des hommes présentant un potentiel reproductif (voir rubrique Données de sécurité préclinique). Comme la pertinence clinique de ces observations n'est pas connue, les patients de sexe masculin doivent être informés du risque éventuel d'une spermatogenèse altérée.
Effets d'autres médicaments sur l'encorafenib
L'encorafenib est principalement métabolisé par le CYP3A4.
Inhibiteurs du CYP3A4
L'administration
concomitante d'inhibiteurs du CYP3A4 modérés (diltiazem) et puissants
(posaconazole) avec des doses uniques d'encorafenib chez des
volontaires sains a entraîné le doublement et le triplement de l'aire
sous la courbe de la concentration en fonction du temps (ASC)),
respectivement, et une augmentation de 44,6 % et 68,3 % de la
concentration maximale d'encorafenib, respectivement. Des prédictions
reposant sur les modèles indiquent que l'effet du posaconazole après
des administrations répétées pourrait être similaire pour l'ASC
(augmentation multipliée par 3) et légèrement plus puissant pour la
Cmax (augmentation multipliée par 2,7). Des prédictions reposant sur
des modèles pour le kétoconazole suggèrent une augmentation multipliée
par environ 5 pour l'ASC de l'encorafenib et une multiplication par 3 à
4 pour la Cmax de l'encorafenib respectivement après administration de
doses de 450 et 300 mg d'encorafenib une fois par jour.
Par
conséquent, l'administration concomitante d'encorafenib et
d'inhibiteurs puissants du CYP3A4 doit être évitée en raison de
l'exposition accrue à l'encorafenib et de l'augmentation possible de la
toxicité, (voir rubrique Propriétés pharmacocinétiques).
Exemples
non exhaustifs d'inhibiteurs puissants du CYP3A4 : le ritonavir,
l'itraconazole, la clarithromycine, la télithromycine, le posaconazole
et le jus de pamplemousse. Si l'usage concomitant d'un inhibiteur
puissant du CYP3A est inévitable, il convient de surveiller
attentivement les patients pour garantir leur sécurité.
L'administration concomitante d'inhibiteurs modérés du CYP3A4 devra être effectuée avec précaution.
Exemples
non exhaustifs d'inhibiteurs modérés du CYP3A4 : l'amiodarone,
l'érythromycine, le fluconazole, le diltiazem, l'amprénavir et
l'imatinib. Lors de l'administration concomitante d'encorafenib et d'un
inhibiteur modéré du CYP3A4, il convient de surveiller attentivement
les patients pour garantir leur sécurité.
Inducteurs du CYP3A4
L'administration
concomitante d'encorafenib avec un inducteur puissant du CYP3A4 n'a pas
été évaluée dans une étude clinique. Cependant, une réduction de
l'exposition à l'encorafenib est probable et risquerait de compromettre
l'efficacité de l'encorafenib. Voici une liste non exhaustive
d'exemples d'inducteurs puissants du CYP3A4 : la carbamazépine, la
rifampicine, la phénytoïne et le millepertuis. D'autres agents ne
présentant aucune induction ou une induction modérée du CYP3A doivent
être envisagés.
Effets de l'encorafenib sur d'autres médicaments
Substrats du CYP
L'encorafenib
est un inducteur puissant du CYP3A4. L'usage concomitant avec des
agents qui sont des substrats du CYP3A4 (par ex., des contraceptifs
hormonaux) risque d'entraîner une perte de l'efficacité de ces agents.
Si la co-administration de susbtrats du CYP3A4 à index thérapeutique
étroit ne peut être évitée, ajuster la dose de ces substrats
conformément à leur RCP approuvé.
L'encorafenib
est un inhibiteur de l'UGT1A1. Les agents concomitants qui sont des
substrats de l'UGT1A1 (tels que le raltégravir, l'atorvastatine, le
dolutégravir) risquent de présenter une exposition accrue et doivent
donc être administrés avec précaution.
Effet de l'encorafenib sur le binimetinib
Alors
que l'encorafenib est un inhibiteur relativement puissant et réversible
de l'UGT1A1, aucune différence au niveau de l'exposition au binimetinib
n'a été observée du point de vue clinique lors de l'administration
concomitante de binimetinib et d'encorafenib.
Substrats de transporteurs
In vivo l'encorafenib
est un inhibiteur de l'OATP1B1, l'OATP1B3 et/ou de la BCRP. La
coadministration de l'encorafénib avec les substrats OATP1B1, OATP1B3
et/ou BCRP (tels que la rosuvastatine, l'atorvastatine, le
méthotrexate) peut entraîner une augmentation des concentrations (voir
rubrique Propriétés pharmacocinétiques).
In vitro l'encorafenib
a la capacité d'inhiber un certain nombre d'autres transporteurs. Les
agents qui sont des substrats des transporteurs rénaux OAT1, OAT3, OCT2
(tels que le furosémide, la pénicilline) ou des agents qui sont des
substrats des transporteurs hépatiques OCT1 (tels que le bosentan) ou
des substrats de la P-gp (tels que le pozaconazole) risquent également
de présenter une exposition accrue. Par conséquent, ces agents,
substrats de transporteurs doivent être co-administrés avec précaution.
Le traitement par l'encorafenib doit être initié et supervisé par un médecin expérimenté dans l'utilisation de médicaments anticancéreux.
Test de mutation BRAF
Avant toute administration de l'encorafenib, les patients doivent avoir la confirmation de la présence d'une mutation BRAF V600E évalué par un dispositif médical de diagnostic in vitro (IVD) marqué CE et destiné à l'usage prévu. Si le DIV marqué CE n'est pas disponible, un autre test validé doit être utilisé.
L'efficacité et la sécurité de l'encorafenib ont été établies uniquement chez les patients atteints d'un mélanome porteur des mutations BRAF V600E et V600K, ou atteints d'un CBNPC porteur d'une mutation BRAF V600E. L'encorafenib ne doit pas être utilisé chez les patients atteints d'un mélanome ou d'un CBNPC ou d'un CRC ayant un statut BRAF de type sauvage.
Posologie
Mélanome et CBNPC
La dose recommandée d'encorafenib est de
450 mg (six gélules de 75 mg) une fois par jour, lorsqu'il est associé au binimetinib.
Cancer colorectal
La dose recommandée d'encorafenib est de
300 mg (quatre gélules de 75 mg) une fois par jour, lorsqu'il est associé au cetuximab.
Adaptation posologique
Mélanome et CBNPC
La prise en charge des effets indésirables peut nécessiter une
réduction de dose, une interruption temporaire ou un arrêt définitif du
traitement par encorafenib (voir Tableaux 1, 3 et 4
ci-dessous). Pour toute information sur la posologie et les adaptations de
doses recommandées pour le binimetinib,
consultez la rubrique Posologie et mode d'administration du Résumé des
Caractéristiques du Produit (RCP) du binimetinib.
Les recommandations de réduction de dose pour l'encorafenib sont présentées dans le Tableau 1.
Tableau 1 : Modifications de doses recommandées pour l'encorafenib utilisé en association avec le binimetinib dans l'indication du mélanome ou du CBNPC
| Niveau de dose |
Dose
d'encorafenib
utilisé en association au binimetinib |
| Dose initiale | 6 gélules de 75 mg (soit 450 mg) une fois par jour |
| 1re réduction de dose | 4 gélules de 75 mg (soit 300 mg) une fois par jour |
| 2e réduction de dose | 3 gélules de 75 mg (soit 225 mg) une fois par jour |
| Réduction de dose suivante |
Dans
l'indication du mélanome
Il existe des données limitées sur la réduction de la dose à 100 mg une fois par jour. L'encorafenib devrait être arrêté de manière définitive si le patient ne peut pas tolérer une dose de 100 mg (2 gélules de 50 mg) une fois par jour. Dans l'indication du CBNPC L'encorafenib doit être arrêté définitivement si le patient ne peut tolérer 225 mg (3 gélules de 75 mg) une fois par jour. |
L'administration d'encorafenib à une dose de 450 mg une fois par jour en monothérapie n'est pas recommandée. Si le binimetinib est temporairement interrompu, la dose d'encorafenib doit être réduite à 300 mg une fois par jour pendant la durée d'interruption du binimetinib (voir rubrique Posologie et mode d'administration du RCP du binimetinib) compte tenu de la moins bonne tolérance de l'encorafenib administré seul à la dose de 450 mg. Si le binimetinib est définitivement arrêté, l'encorafenib devrait être arrêté.
Si l'encorafenib est temporairement interrompu (voir les Tableaux 3 et 4), le binimetinib doit être interrompu. Si l'encorafenib est définitivement arrêté, le binimetinib doit également être définitivement arrêté.
Si des toxicités liées au traitement surviennent, dans ce cas l'encorafenib
et le binimetinib
doivent être réduits, interrompus ou définitivement arrêtés. Des adaptations
posologiques sont nécessaires uniquement pour le binimetinib
(effets indésirables principalement liés au binimetinib)
dans les cas suivants : un décollement de l'épithélium pigmentaire de la
rétine, une occlusion de la veine rétinienne (OVR), une pneumopathie
interstitielle diffuse/pneumopathie inflammatoire, une dysfonction cardiaque,
une élévation de la créatine phosphokinase (CPK), une
rhabdomyolyse et une maladie thromboembolique veineuse.
Si l'une de ces toxicités survient, consultez la rubrique Posologie
et mode d'administration du RCP du binimetinib pour
connaître les instructions d'adaptation posologique du binimetinib.
Cancer colorectal
La prise en charge des effets indésirables peut nécessiter une
réduction de dose, une interruption temporaire ou un arrêt définitif du
traitement par encorafenib (voir Tableaux 2, 3 et 4
ci-dessous). Pour toute information sur la posologie et les adaptations de
doses recommandées pour le cetuximab,
consultez la rubrique Posologie et mode d'administration du RCP du cetuximab.
Les recommandations de réduction de dose pour l'encorafenib sont présentées dans le Tableau 2.
Tableau 2 : Modifications de dose recommandées pour l'encorafenib utilisé en association avec le cetuximab dans l'indication du CCR
| Niveau de dose |
Dose
d'encorafenib
utilisé en association avec le cetuximab |
| Dose initiale | 4 gélules de 75 mg (soit 300 mg) une fois par jour |
| 1re réduction de dose | 3 gélules de 75 mg (soit 225 mg) une fois par jour |
| 2e réduction de dose | 2 gélules de 75 mg (soit 150 mg) une fois par jour |
Si l'encorafenib est définitivement arrêté,
le cetuximab
doit être définitivement arrêté.
Si le cetuximab est définitivement arrêté, l'encorafenib doit être définitivement arrêté.
Mélanome, cancer colorectal et CBNPC
Les adaptations posologiques en cas d'effets indésirables sont
indiquées ci-dessous et dans les Tableaux 3 et 4.
En cas de survenue de nouvelles tumeurs cutanées primitives : aucune modification de dose n'est requise pour l'encorafenib.
En cas de survenue de nouvelles tumeurs non cutanées primitives positives à la mutation RAS : l'arrêt définitif du traitement par encorafenib doit être envisagé.
Tableau 3 : Adaptations posologiques recommandées pour l'encorafenib utilisé en association au binimetinib ou en association au cetuximab lors de la survenue de certains effets indésirables
| Sévérité des effets indésirablesa | Encorafenib |
| Réactions cutanées | |
|
L'encorafenib
doit être maintenu.
Si l'éruption cutanée s'aggrave ou ne s'améliore pas au bout de 2 semaines de traitement, l'encorafenib doit être interrompu jusqu'à une amélioration à un grade 0 ou 1, puis réintroduit à la même dose. |
|
L'encorafenib doit être interrompu jusqu'à une amélioration à un grade 0 ou 1 et réintroduit à la même dose s'il s'agit de la première survenue ou alors réintroduit à une dose réduite s'il s'agit d'une récidive de grade 3. |
|
L'encorafenib doit être définitivement arrêté. |
| Érythrodysesthésie palmo-plantaire | |
|
L'encorafenib
doit être maintenu et des traitements d'appoint tels que des traitements
locaux doivent être instaurés
|
|
L'encorafenib
doit être interrompu et des traitements d'appoint tels que des traitements
locaux doivent être instaurés et l'état du patient doit être réévalué toutes
les semaines
|
| Uvéite comprenant iritis et iridocyclite | |
|
En
cas d'uvéite de grade 1 ou 2 n'ayant pas répondu à un traitement oculaire
spécifique (tel qu'un traitement local) ou en cas d'uvéite de grade 3, l'encorafenib
doit être interrompu et un contrôle ophtalmologique doit être répété dans les
2 semaines.
|
|
L'encorafenib doit être définitivement arrêté et un suivi avec contrôle ophtalmologique doit être réalisé. |
| Allongement de l'intervalle QTc | |
|
L'encorafenib
doit être interrompu (consulter la rubrique Mises en garde spéciales et
précautions d'emploi concernant la surveillance du QTc).
L'encorafenib doit être repris à une dose réduite dès lors que l'intervalle QTcF ≤ 500 ms. L'encorafenib doit être définitivement arrêté au-delà d'une récidive. |
|
L'encorafenib doit être définitivement arrêté (consulter la rubrique Mises en garde spéciales et précautions d'emploi concernant la surveillance du QTc). |
| Anomalies biologiques hépatiques | |
|
L'encorafenib
doit être maintenu.
|
|
L'encorafenib
doit être suspendu jusqu'à 4 semaines.
|
|
L'encorafenib
doit être suspendu jusqu'à 4 semaines.
|
|
L'arrêt définitif de l'encorafenib devra être envisagé. |
|
L'encorafenib doit être définitivement arrêté. |
a Critères communs
de terminologie de l'institut national contre le cancer pour les événements
indésirables (« National Cancer Institute Common Terminology
Criteria
for Adverse Events », NCI CTCAE) version 4.03
Tableau 4 : Adaptations posologiques recommandées pour l'encorafenib utilisé en association au binimetinib ou en association avec le cetuximab lors de la survenue d'autres effets indésirables
| Sévérité des effets indésirables | Encorafenib |
|
L'encorafenib
doit être suspendu jusqu'à 4 semaines
|
|
L'encorafenib
doit être suspendu jusqu'à 4 semaines.
Ou alors, l'encorafenib doit être définitivement arrêté. |
|
L'arrêt définitif de l'encorafenib devra être envisagé. |
|
L'encorafenib doit être définitivement arrêté. |
Durée du traitement
Il convient de continuer le traitement jusqu'à ce qu'il n'y ait
plus de bénéfice pour le patient ou en cas de survenue d'une toxicité
inacceptable.
Omissions de doses
En cas d'oubli d'une dose d'encorafenib, la
dose d'encorafenib
ne doit pas être prise s'il reste moins de 12 heures avant la prise de la
prochaine dose prévue.
Vomissement
En cas de vomissements après l'administration d'encorafenib,
le patient ne doit pas prendre de dose supplémentaire et prendra la prochaine
dose comme initialement prévu.
Populations spéciales
Personnes âgées
Aucune adaptation posologique n'est nécessaire pour les patients
âgés de 65 ans et plus (voir rubrique Propriétés pharmacocinétiques).
Insuffisance hépatique
Les patients atteints d'une insuffisance hépatique légère à sévère
peuvent être davantage exposés à l'encorafenib (voir
rubrique Propriétés pharmacocinétiques).
Encorafénib doit être
administré avec prudence à une dose de 300 mg une fois par jour chez les
patients atteints d'une insuffisance hépatique légère (classe A de Child-Pugh).
Aucune recommandation posologique ne peut être faite chez les
patients atteints d'une insuffisance hépatique modérée (classe B de Child-Pugh)
ou sévère
(classe C de Child-Pugh).
Insuffisance rénale
Aucun ajustement posologique n'est nécessaire chez les patients
présentant une insuffisance rénale légère à modérée selon une analyse
pharmacocinétique (PK) de population. Aucune donnée clinique n'est disponible
avec l'encorafenib
administré chez les patients présentant une insuffisance rénale sévère. Par
conséquent, la nécessité éventuelle d'un ajustement de la dose ne peut pas être
déterminée. L'encorafenib doit être utilisé avec
prudence chez les patients présentant une insuffisance rénale sévère (voir les
rubriques Mises en garde spéciales et précautions d'emploi et Propriétés
pharmacocinétiques).
Population pédiatrique
La sécurité et l'efficacité de l'encorafenib
n'ont pas encore été établies chez les enfants et les adolescents. Aucune
donnée n'est disponible.
Mode d'administration
Braftovi s'administre par voie orale. Les gélules doivent être avalées entières avec de l'eau. Elles peuvent être prises pendant ou en dehors des repas. L'administration concomitante d'encorafenib et de jus de pamplemousse doit être évitée (voir les rubriques Mises en garde spéciales et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions).
Durée de conservation :
3 ans.
Précautions particulières de conservation :
À conserver à une température ne dépassant pas 30 °C.
À conserver dans l'emballage d'origine à l'abri de l'humidité.
Sans objet.
Symptômes
À des doses
d'encorafenib comprises entre 600 et 800 mg une fois par jour, une
insuffisance rénale (hypercréatinémie de grade 3) a été observée chez 3
patients sur 14. La dose la plus élevée a été administrée à la suite
d'une erreur de dose chez un patient ayant reçu l'encorafenib à une
dose de 600 mg deux fois par jour pendant 1 jour (dose totale de 1 200
mg). Les effets indésirables rapportés par ce patient étaient de grade
1 à type de nausées, vomissements et vision trouble tous résolutifs par
la suite.
Conduite à tenir
Il n'y a pas de traitement spécifique en cas de surdosage.
Compte tenu de la
liaison modérée de l'encorafenib aux protéines plasmatiques,
l'hémodialyse serait probablement inefficace dans le traitement d'un
surdosage par l'encorafenib. Il n'y a pas d'antidote connu contre
l'encorafenib. En cas de surdosage, l'encorafenib doit être interrompu
et la fonction rénale doit être surveillée ainsi que la survenue des
effets indésirables. Un traitement symptomatique et des soins d'appoint
doivent être instaurés si besoin.
Classe pharmacothérapeutique : agents antinéoplasiques, inhibiteurs de la protéine kinase, Code ATC : L01EC03
Mécanisme d'action
L'encorafenib est une petite molécule inhibitrice ATP-compétitive, puissante et hautement sélective de la kinase de RAF. La concentration inhibitrice 50 % (CI50) de l'encorafenib par rapport aux enzymes BRAF V600E, BRAF et CRAF était, respectivement de 0,35, 0,47 et 0,30 nM. La demi-vie de dissociation de l'encorafenib était > 30 heures et s'est traduite par une inhibition prolongée de pERK. L'encorafenib inhibe la voie RAF/MEK/ERK dans les cellules tumorales exprimant différentes formes mutées de la kinase BRAF (V600E, D et K). Plus précisément, l'encorafenib inhibe la prolifération cellulaire in vitro et in vivo des mélanomes exprimant les mutations BRAF V600E, D et K et des cancers colorectaux exprimant la mutation BRAF V600E. L'encorafenib n'inhibe pas la signalisation RAF/MEK/ERK dans les cellules présentant un BRAF de type sauvage.
Association avec le binimetinib
L'association de l'encorafenib et du binimetinib (inhibiteur MEK, voir rubrique Propriétés
pharmacodynamiques du binimetinib SmPC) inhibe la
voie MAPK conduisant à une activité anti-tumorale plus élevée que le traitement
en monothérapie, par l'un ou l'autre médicament.
Association avec le cetuximab
L'un des principaux mécanismes de résistance du CCR exprimant la mutation BRAF
aux inhibiteurs du gène RAF a été idenfié comme la
réactivation du récepteur EGFR avec contournement de la transduction du signal
via la mutation BRAF. Une amélioration de l'efficacité antitumorale
a été démontrée avec les associations d'un inhibiteur de BRAF, par exemple l'encorafenib, et d'agents ciblant le récepteur EGFR, par
exemple le cetuximab, dans des modèles non cliniques.
Efficacité et sécurité clinique
Mélanome non résécable ou
métastatique exprimant une mutation BRAF V600
La sécurité et l'efficacité de l'encorafenib associé
au binimetinib ont été évaluées dans un essai de
phase III randomisée (1:1:1) en deux parties, multicentrique, ouvert et
contrôlé par un traitement actif, chez des patients atteints d'un mélanome
inopérable ou métastatique porteurs d'une mutation BRAF V600 E ou K (étude
CMEK162B2301), mis en évidence à l'aide d'un test de détection des mutations de
BRAF. Les patients présentaient un mélanome primitif histologiquement confirmé
cutané ou inconnu, mais ceux qui étaient atteints d'un mélanome choroïdien ou
muqueux ont été exclus. Les patients étaient autorisés à recevoir un traitement
adjuvant préalable et une ligne préalable d'immunothérapie pour une maladie
localement avancée inopérable ou métastatique. Un traitement préalable par des
inhibiteurs de BRAF/MEK n'était pas autorisé.
Étude - CMEK162B2301, partie 1
Dans la partie 1, les patients de l'étude ont été randomisés pour recevoir l'encorafenib 450 mg par voie orale une fois par jour et le binimetinib 45 mg par voie orale deux fois par jour
(Combo450, n = 192), l'encorafenib 300 mg par voie
orale une fois par jour (Enco 300, n = 194) ou le vemurafenib 960 mg par voie orale deux fois par jour
(ci-après dénommé Vem, n = 191). Le traitement a été
poursuivi jusqu'à progression de la maladie ou une toxicité inacceptable. La
randomisation a été stratifiée selon les stades (IIIB, IIIC, IVM1a ou IVM1b,
contre IVM1c) de la classification de l'AJCC (American Joint Committee on Cancer) et l'indice de performance ECOG (Eastern Cooperative Oncology Group) (0 contre 1) et selon
qu'une immunothérapie préalable a été reçue ou non pour la maladie inopérable
ou métastatique.
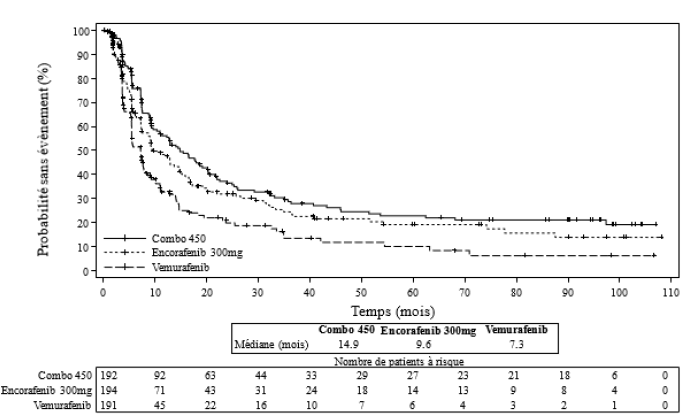
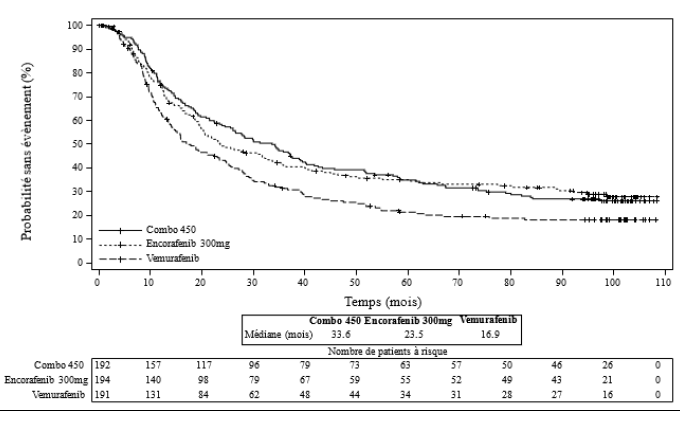
Le critère d'évaluation principal en termes d'efficacité était la survie sans progression (SSP) du bras Combo450 comparé au vemurafenib comme l'a évalué un comité indépendant de revue centralisée (BIRC, Blinded Independent Review Committee). La survie sans progression évaluée par les investigateurs (évaluation des investigateurs) était une analyse complémentaire de l'analyse du critère principal. Un critère d'évaluation secondaire supplémentaire comprenait la survie sans progression de Combo450 comparée à Enco 300. D'autres comparaisons secondaires de l'efficacité entre Combo450 et soit le vemurafenib, soit l'Enco 300 comprenaient la survie globale (SG), le taux de réponse objective (ORR), la durée de la réponse (DR) et le taux de contrôle de la maladie (TCM) comme évalués par le BIRC et par l'évaluation des investigateurs.
L'âge médian des patients était de 56 ans (de 20 à 89 ans), 58 % étaient des hommes, 90 % de type caucasien et 72 % des patients présentaient un indice de performance ECOG de0 à l'inclusion. La plupart des patients étaient atteints d'une maladie métastatique (95 %) et étaient de Stade IVM1c (64 %) ; 27 % des patients présentaient à l'inclusion un taux élevé de lactate déshydrogénase sérique (LDH) et 45 % des patients avaient au moins 3 organes présentant des lésions tumorales à l'inclusion et 3,5 % avaient des métastases cérébrales. 27 patients (5 %) avaient préalablement reçu des inhibiteurs de « points de contrôle » (anti-PD1/PDL1 ou ipilimumab [anti-CTL-A4]) (8 patients dans le bras Combo450 (4 %) ; 7 patients dans le bras vemurafenib (4 %) ; 12 patients dans le bras Enco 300 (6 %)) dont 22 patients dans un cadre métastatique (6 patients dans le bras Combo450, 5 patients dans le bras vemurafenib, 11 patients dans le bras Enco 300) et 5 patients dans le cadre d'un traitement adjuvant (2 patients dans le bras Combo450, 2 patients dans le bras vemurafenib, 1 patient dans le bras Enco 300).
La durée médiane d'exposition était de 11,7 mois chez les patients traités par Combo450, de 7,1 mois chez les patients traités par Enco 300 et de 6,2 mois chez les patients traités par vemurafenib. La dose- intensité relative (RDI) médiane pour Combo450 était de 100 % pour l'encorafenib et de 99,6 % pour le binimetinib ; la RDI médiane pour Enco 300 était de 86,2 % et de 94,5 % pour le vemurafenib.
La 1re partie de l'étude CMEK162B2301 a démontré une amélioration statistiquement significative de la survie sans progression chez les patients traités par Combo450 par rapport à ceux traités par vemurafenib. Le tableau 6 résume la survie sans progression et les autres résultats d'efficacité basés sur la revue faite en aveugle par un comité indépendant de radiologues.
Les résultats d'efficacité basés sur l'évaluation de l'insvestigateur étaient similaires à l'évaluation centrale indépendante. Des analyses de sous-groupes en dehors de toute stratification ont démontré des estimations ponctuelles en faveur de Combo 450, dont le LDH à l'inclusion, le statut de la performance ECOG et la phase AJCC.
Tableau 6 : Étude CMEK162B2301, partie 1 : résultats de la survie sans progression et de la réponse globale confirmée (examen central indépendant,)
|
Encorafenib + binimetinib N = 192 (Combo450) |
Encorafenib
N = 194 (Enco300) |
Vemurafenib
N = 191 (Vem) |
|
| Cut-off au 19 mai 2016 | |||
| Analyse primaire | |||
| Nombre d'événements (%) | 98 (51,0) | 96 (49,5) | 106 (55,5) |
|
Médiane,
en mois (IC à 95 %) |
14,9
(11,0 ; 18,5) |
9,6
(7,5 ;14,8) |
7,3
(5,6 ; 8,2) |
|
Hazard
Ratio (HR)a (IC à 95 %) (par rapport à Vem) Valeur p (test Mantel- Haenzel stratifié)b |
0,54
(0,41 ; 0,71) < 0,0001 |
||
|
Hazard
Ratio a (IC à 95 %) (par rapport à Vem) Valeur nominale de p |
0,68
(0,52 ; 0,90) 0,007 |
||
|
Hazard
Ratioa (IC à 95 %) (par rapport à Enco 300) Valeur p (test Mantel- Haenzel stratifié)b |
0,75
(0,56 ; 1,00) 0,051 |
|
|
| Réponses globales confirmées | |||
|
Taux
de réponse globale, n (%) (IC à 95 %) |
121
(63,0) (55,8 ; 69,9) |
98
(50,5) (43,3 ; 57,8) |
77
(40,3) (33,3 ; 47,6) |
| Réponse complète, n (%) | 15 (7,8) | 10 (5,2) | 11 (5,8) |
| Réponse partielle, n (%) | 106 (55,2) | 88 (45,4) | 66 (34,6) |
| Maladie stable, n (%) | 46 (24,0) | 53 (27,3) | 73 (38,2) |
|
Taux
de contrôle de la maladie, n (%) (IC à 95 %) |
177
(92,2) (87,4, 95,6) |
163
(84,0) (78,1 ; 88,9) |
156
(81,7)
(75,4 ; 86,9) |
| Durée de réponse | |||
|
Médiane,
en mois (IC à 95 %) |
16,6
(12,2 ; 20,4) |
14,9
(11,1 à Non estimable) |
12,3
(6,9 ; 16,9) |
IC
= Intervalle de confiance ; Taux de contrôle de la maladie (Réponse Complète + Réponse
Partielle + Maladie stable + Non-Réponse Complète/Non-Progression de la maladie ;
Non-Réponse complète/Non-Progression de la maladie s'applique uniquement aux
patients sans lésion cible qui n'ont pas atteint la Réponse Complète ou n'ont
pas une Progression de la maladie) ; HR = rapport des risques instantanés
(Hazard Ratio)
Vem = vemurafenib.
a Rapport des risques instantanés selon un modèle à risques proportionnels de Cox stratifié
b Valeur p du test Mantel-Haenzel (test bilatéral)
Vem = vemurafenib.
a Rapport des risques instantanés selon un modèle à risques proportionnels de Cox stratifié
b Valeur p du test Mantel-Haenzel (test bilatéral)
Qualité de vie (QdV) (cut-off au 19 mai 2016)
Le
score FACT-M (Functional Assessment
of Cancer Therapy-Melanoma), le questionnaire de
qualité de vie de l'Organisation européenne pour la recherche et le traitement
du cancer (EORTC QLQ-C30) et le questionnaire EQ-5D-5L (EuroQoL-5 Dimension-5 Level) ont été utilisés pour explorer les mesures
rapportées par les patients, concernant la qualité de vie liée à la santé, les
critères fonctionnels, les symptômes liés au mélanome et les évènements
indésirables liés au traitement. Une détérioration définitive de 10 % des
scores FACT-M et l'EORTC QLQ-C30 a été considérablement retardée chez les
patients traités par Combo450 par rapport aux autres traitements. Le temps
médian jusqu'à détérioration définitive de 10 % du score FACT-M n'a pas été
atteint dans le bras Combo450 et était de 22,1 mois (IC à 95 % 15,2 ; non
estimable) dans le bras vemurafenib avec un Hazard
Ratio pour la différence de 0,46 (IC à 95 % 0,29 à 0,72). Une analyse du délai
jusqu'à une détérioration définitive de 10 % dans le score EORTC QLQ-C30 a
donné des résultats semblables.
Les
patients recevant Combo450 n'ont signalé à toutes les visites aucun changement
ou une légère amélioration du changement moyen par rapport à l'indice EQ-5D-5L
à l'inclusion, alors que les patients recevant le vemurafenib
ou l'encorafenib ont signalé des diminutions à toutes
les visites (avec des différences significatives sur le plan statistique). Une
évaluation du changement de note au fil du temps a donné la même tendance pour
l'EORTC QLQ-C30 et à toutes les visites pour FACT-M.
Étude CMEK162B2301, partie 2
La
partie 2 de l'étude CMEK162B2301 était conçue pour évaluer la contribution du binimetinib dans l'association de l'encorafenib
au binimetinib.
La
survie sans progression de l'encorafenib à 300 mg
administré par voie orale une fois par jour en association au binimetinib à 45 mg administré par voie orale deux fois par
jour (COMBO300, n = 258) a été comparée à la survie sans progression Enco 300, (n = 280, dont 194 patients de la Partie 1 et 86
patients de la Partie 2). Le recrutement dans la partie 2 a commencé après la
randomisation de tous les patients de la partie 1.
Analyse d'efficacité finale de l'étude CMEK162B2301, parties 1 et 2 (cut-off au 31 mars 2023)
L'analyse d'efficacité finale était cohérente avec les résultats de l'analyse intermédiaire et a montré un bénéfice en termes de survie globale pour Combo 450 par rapport au vemurafenib (Hazard Ratio (HR) 0,67 [95% IC:0.53,0.84] avec une survie globale médiane de 33,6 mois contre 16,9 mois). Les résultats de la SSP et du TRO selon le BIRC) ont également confirmé un avantage numérique en faveur de Combo 450, avec une SSP médiane de 7,6 mois plus longue dans le groupe Combo 450 par rapport au groupe vemurafenib, voir tous les résultats d'efficacité finaux détaillés dans le tableau 7 et les figures 1 et 2 ci- dessous.
De plus, l'analyse finale de la partie 2 a montré une différence numérique en terme de SG pour Combo 300 (partie 2) par rapport à la monothérapie Enco 300 (parties 1+2) (HR 0,89 [IC à 95 % : 0,72, 1,09] avec une SG médiane de 27,1 mois [IC à 95 % : 21,6-33,3] contre 22,7 mois [IC à 95 % : 19,3-29,3]). La SSP médiane est restée plus longue dans le bras Combo 300 (partie 2) que dans le groupe Enco 300 (parties 1+2) avec des estimations de SSP médianes de 12,9 mois (IC à 95 % : 10,9, 14,9) et 9,2 mois (IC à 95 % : 7,4, 11,1), respectivement. Le taux de réponse objective confirmé (selon le BIRC) était de 67,8 % (IC à 95 % : 61,8, 73,5) et de 51,4 % (IC à 95 % : 45,4, 57,4) dans les groupes Combo 300 (partie 2) et Enco 300 (parties 1 + 2), respectivement. Des résultats similaires ont été observés par l'évaluation de l'investigateur.
Tableau 7 : Etude CMEK162B2301 : Résultats définitifs sur SSP, SG et TRO confirmés (cut-off au 31 mars 2023)
|
Encorafenib + binimetinib N = 192 (Combo 450) |
Encorafenib N = 194 (Enco 300) |
Vemurafenib
N = 191 (Vem) |
|
| Analyse finale : cut-off au 31 Mars 2023 | |||
| SSP (selon le BIRC) | |||
| Nombre d'événements (%) |
123
(64.1) |
119
(61.3) |
121
(63.4) |
|
Médiane
a, en mois (IC à 95 %) |
14.9
(11.0, 20.2) |
9.6
(7.4, 14.8) |
7.3
(5.6, 7.9) |
|
Hazard
Ratioc (IC à 95 %) (par rapport à Vem) Valeur p du log-rank (unilatéral)* |
0.51
(0.39, 0.66)
< 0.0001 |
0.68
(0.53, 0.88) 0.0017 |
|
|
Hazard
Ratioc (IC à 95 %) (par rapport à Enco300) Valeur p du log-rank (unilatéral)* |
0.77
(0.60, 0.99) 0.0214 |
||
| Survie globale | |||
| Nombre d'événements (%) |
139
(72.4) |
125
(64.4) |
147
(77.0) |
|
Médiane
a, en mois (IC à 95 %) |
33.6
(24.4, 39.2) |
23.5
(19.6, 33.6) |
16.9
(14.0, 24.5) |
|
Probabilité
de survie b à 1 an % (95 % IC) |
75.5 (68.8, 81.0) |
74.6 (67.6, 80.3) |
63.1 (55.7, 69.7) |
| à 2 ans % (95 % IC) | 57.7 (50.3, 64.3) | 49.1 (41.5, 56.2) | 43.2 (35.9, 50.2) |
| à 3 ans % (95 % IC) | 46.5 (39.3, 53.4) | 40.9 (33.6, 48.1) | 31.4 (24.8, 38.2) |
| à 5 ans % (95 % IC) | 34.7 (28.0, 41.5) | 34.9 (27.9, 42.0) | 21.4 (15.7, 27.8) |
| à 9 ans % (95 % IC) | 26.0 (19.8, 32.5) | 27.8 (21.1, 34.8) | 18.2 (12.8, 24.3) |
|
HRc (95 % IC) (vs Vem)
Valeur p du log-rank (unilatéral)* |
0.67
(0.53, 0.84) 0.0003 |
0.74
(0.58, 0.94) 0.0063 |
|
|
HRc (95 % IC) (vs Enco 300) Valeur p du log-rank (unilatéral)* |
0.93
(0.73, 1.19) 0.2821 |
||
| Réponse globale confirmée optimale (selon le BIRC) | |||
|
TRO
confirmée d, n (%) (95 % IC) |
123
(64.1) (56.8, 70.8) |
100
(51.5) (44.3, 58.8) |
78
(40.8) (33.8, 48.2) |
| RC, n (%) | 29 (15.1) | 17 (8.8) | 16 (8.4) |
| RP, n (%) | 94 (49.0) | 83 (42.8) | 62 (32.5) |
| MS, n (%) | 44 (22.9) | 52 (26.8) | 71 (37.2) |
|
TCM
d, n (%) (95 % IC) |
177
(92.2) (87.4, 95.6) |
163
(84.0) (78.1, 88.9) |
155
(81.2) (74.8, 86.4) |
| Durée de la réponse (selon le BIRC) | |||
|
Médiane,
mois (95 % IC) |
18.6
(12.7, 27.6) |
15.5
(11.1, 29.5) |
12.3
(6.9, 14.5) |
|
IC
= intervalle de confiance ; RC = réponse complète ; RP = réponse partielle ;
MS = maladie stable ; TCM : taux de contrôle de la maladie (RC+RP+MS+Non- RC/Non-Progression de la maladie ; HR = hazard ration ; TRO : taux de réponse objective (RC+RP). La RP et la CR sont confirmées par des évaluations répétées effectuées au moins 4 semaines après que les critères de réponse ont été établis pour la première fois. a La médiane (temps jusqu'à l'évènement) et ses IC à 95 % sont générés par l'estimation KM avec la méthode Broomeyer et Crowley b Probabilité de survie (obtenues à partir des estimations de survie KM, formule de Greenwood utilisée pour les IC) c Le test du log-rank et le modèle Cox PH sont stratifiés par stade IVRS AJCC et statut de performance ECOG. d Les IC estimés à 95 % sont obtenus à l'aide de la méthode exacte Clopper-Pearson * valeur p nominale |
|||
Figure 1 Étude CMEK162B2301 : Diagramme de Kaplan-Meier de SSP par BIRC (cut-off au 31 mars 2023)
Figure 2 Etude CMEK162B2301 : Diagramme de Kaplan-Meier de la survie globale (cut-off au 31 Mars 2023)
Cancer colorectal métastatique exprimant la mutation BRAF
V600E - Étude ARRAY-818-302
L'encorafenib en association au cetuximab
a été évalué dans une étude multicentrique, randomisée, ouverte et contrôlée
par traitement actif (ARRAY 818-302 BEACON CRC). Les patients admissibles dans
l'étude devaient être atteints d'un cancer colorectal métastatique exprimant la
mutation BRAF V600E qui avait progressé après 1 ou 2 traitements antérieurs.
Les patients recrutés pouvaient recevoir du cetuximab
selon le statut mutationnel RAS de leur tumeur conformément à la notice
approuvée localement. Les patients ne devaient pas avoir été déjà traités par
des inhibiteurs RAF, des inhibiteurs MEK ou des inhibiteurs EGFR. La
randomisation a été stratifiée selon l'indice de performance de l'Eastern Cooperative Oncology Group (ECOG), l'utilisation antérieure d'irinotécan et la source de cetuximab.
Au total 665 patients ont été randomisés (selon un rapport 1:1:1) pour recevoir l'encorafenib 300 mg administré par voie orale une fois par jour en association au cetuximab dosé selon son RCP approuvé (n = 220), ou l'encorafenib 300 mg administré par voie orale une fois par jour en association au binimetinib 45 mg administré par voie orale deux fois par jour et au cetuximab dosé selon son RCP approuvé (n = 224) ou un traitement de contrôle (irinotécan en association au cetuximab ou irinotécan/5-fluorouracil/acide folinique (FOLFIRI) en association au cetuximab, n = 221). Le traitement a été poursuivi jusqu'à la progression de la maladie ou une toxicité inacceptable.
Les critères d'évaluation en termes d'efficacité étaient la survie globale (SG) et le taux de réponse globale (TRG), tels qu'évalués par un comité indépendant de revue centralisée en aveugle (BIRC), comparant l'encorafenib 300 mg en association au cetuximab par rapport au traitement contrôle. Les autres mesures de l'efficacité sont résumées dans le Tableau 8 ci-dessous.
L'âge
médian des patients était de 61 ans (de 26 à 91), 47 % étaient des hommes et 83
% étaient de race blanche. 51 % des patients présentaient un indice de
performance ECOG de 0 à l'inclusion et 51 % avaient préalablement reçu de l'irinotécan. 46,8 % des patients avaient au moins 3 organes
présentant des lésions tumorales à l'inclusion.
La
durée médiane d'exposition était de 3,2 mois chez les patients recevant l'encorafenib 300 mg en association au cetuximab
et de 1,4 mois chez les patients traités par irinotécan/cetuximab ou FOLFIRI/cetuximab
(bras contrôle). Chez les patients traités par l'association d'encorafenib 300 mg et de cetuximab,
la dose-intensité relative (RDI) médiane était de 98 % pour l'encorafenib et de 93,5% pour le cetuximab.
Dans le bras contrôle, la RDI médiane était de 85,4 % pour le cetuximab, de 75,7 % pour l'irinotécan,
et dans le sous-groupe de patients ayant reçu de l'acide folinique
et du 5- fluorouracil, la RDI médiane était de 75,2 %
et 75 %, respectivement.
Une amélioration statistiquement significative de la SG, du TRG et de la SSP a été démontrée avec l'encorafenib 300 mg en association au cetuximab par rapport au traitement contrôle. Les résultats de l'efficacité sont résumés dans le Tableau 8 et les Figures 3 et 4.
Les résultats d'efficacité basés sur l'évaluation de l'investigateur étaient concordants avec l'évaluation centrale indépendante.
Tableau 8 : Étude ARRAY-818-302 : Résultats d'efficacité
|
Encorafenib en association
au cetuximab |
Irinotécan en association au
cetuximab ou FOLFIRI en association au cetuximab (Contrôle) |
|
| Cut-off au 11 février 2019 (analyse primaire) | ||
| SG | ||
| Nombre de patients a | 220 | 221 |
| Nombre d'événements (%) | 93 (42,3) | 114 (51,6) |
| Médiane, en mois (IC à 95 %) | 8,4 (7,5 - 11,0) | 5,4 (4,8 ; 6,6) |
|
HR
(IC à 95 %)b,c (vs Contrôle)
Valeur p b,c |
0,60
(0,41-0,88) 0,0002 |
|
|
Durée
médiane du suivi, en mois (IC à 95 %) |
7,6
(6,4 ; 9,20) |
7,2
(6,1 ; 8,1) |
| TRG (selon le BIRC) | ||
| Nombre de patients e | 113 | 107 |
|
TRG
n (%) (IC à 95 %)f |
23
(20,4)
(13,4 ; 29,0) |
2
(1,9)
(0,2 ; 6,6) |
| Valeur p b,d,g | < 0,0001 | |
| RC, n (%) | 6 (5,3) | 0 |
| RP, n (%) | 17 (15,0) | 2 (1,9) |
| MS, n (%) | 57 (50,4) | 26 (24,3) |
|
TCM,
n (%)
(IC à 95 %)f |
84
(74,3) (65,3 ; 82,1) |
33
(30,8)
(22,3 ; 40,5) |
| SSP (selon le BIRC) | ||
| Nombre de patients a | 220 | 221 |
| Nombre d'événements (%) | 133 (60,5) | 128 (57,9) |
| SSP médiane, mois (IC à 95 %) | 4,2 (3,7 ; 5,4) | 1,5 (1,5 ; 1,7) |
|
HR
(IC à 95 %)b,c
Valeur p b,d |
0,40
(0,30 ; 0,55)
< 0,0001 |
|
| Analyse actualisée, cut-off au 15 août 2019 | ||
| SG | ||
| Nombre de patients a | 220 | 221 |
| Nombre d'événements (%) | 128 (58,2) | 157 (71,0) |
| Médiane, en mois (IC à 95 %) | 9,3 (8,0 ; 11,3) | 5,9 (5,1 ; 7,1) |
|
HR
(IC à 95 %)b (vs Contrôle)
Valeur p b,d,h |
0,61
(0,48 ; 0,77) < 0,0001 |
|
|
Durée
médiane du suivi, en mois (IC à 95 %) |
12,3
(11,1 ; 14,1) |
12,9
(10,9 ; 14,6) |
| TRG (selon le BIRC) | ||
| Nombre de patients a | 220 | 221 |
|
TRG
n (%)
(IC à 95 %)f |
43
(19,5) (14,5 ; 25,4) |
4
(1,8) (0,5 ; 4,6) |
| Valeur pb,d,g,h | < 0,0001 | |
| RC, n (%) | 7 (3,2) | 0 |
| RP, n (%) | 36 (16,4) | 4 (1,8) |
| MS, n (%) | 117 (53,2) | 59 (26,7) |
|
TCM,
n (%) (IC à 95 %)f |
167
(75,9) (69,7 ; 81,4) |
69
(31,2) (25,2 ; 37,8) |
| SSP (selon le BIRC) | ||
| Nombre de patientsa | 220 | 221 |
| Nombre d'événements (%) | 167 (75,9) | 147 (66,5) |
|
SSP
médiane, en mois (IC à 95 %) |
4,3
(4,1 ; 5,5) |
1,5
(1,5 ; 1,9) |
|
HR
(IC à 95 %)b
Valeur pb,d,h |
0,44
(0,35 ; 0,55) < 0,0001 |
|
IC
= intervalle de confiance ; RC = réponse complète ; HR = Hazard ratio (rapport
des risques instantanés) ; TRG = taux de réponse globale ; SG = survie globale
; RP = réponse partielle ;
MS = maladie stable ; TCM : taux de contrôle de la maladie (Réponse Complète + Réponse Partielle + Maladie stable + Non-Réponse Complète/Non-Progression de la maladie ; Non-Réponse complète/Non-Progression de la maladie s'applique uniquement aux patients avec maladie non mesurable qui n'ont pas atteint la Réponse Complète ou n'ont pas une Progression de la maladie)
a Phase III randomisée, set d'analyse complète
b Stratifié par IP ECOG, source du cetuximab et utilisation préalable d'irinotécan au moment de la randomisation
c IC répété dérivé des bornes de Lan DeMets O'Brien-Fleming associées à la fraction d'information observée à l'analyse intermédiaire
d Unilatéral
e Parmi les 331 premiers patients randomisés
f Méthode de Clopper-Pearson
g Test Cochran Mantel-Haenszel
h Valeur nominale de p
MS = maladie stable ; TCM : taux de contrôle de la maladie (Réponse Complète + Réponse Partielle + Maladie stable + Non-Réponse Complète/Non-Progression de la maladie ; Non-Réponse complète/Non-Progression de la maladie s'applique uniquement aux patients avec maladie non mesurable qui n'ont pas atteint la Réponse Complète ou n'ont pas une Progression de la maladie)
a Phase III randomisée, set d'analyse complète
b Stratifié par IP ECOG, source du cetuximab et utilisation préalable d'irinotécan au moment de la randomisation
c IC répété dérivé des bornes de Lan DeMets O'Brien-Fleming associées à la fraction d'information observée à l'analyse intermédiaire
d Unilatéral
e Parmi les 331 premiers patients randomisés
f Méthode de Clopper-Pearson
g Test Cochran Mantel-Haenszel
h Valeur nominale de p
Figure 3 : Étude ARRAY-818-302 : Courbes de Kaplan-Meier de la survie globale (cut-off au 11 février 2019)
Figure 4: Étude ARRAY-818-302 : Courbes de Kaplan-Meier de la survie globale (cut-off au 15 août 2019)
Cancer
bronchopulmonaire non à petites cellules muté BRAF
V600 - Étude ARRAY-818-202
La
sécurité et l'efficacité de l'encorafenib en
association avec le binimetinib ont été étudiées dans
le cadre d'une étude de phase II, ouverte, multicentrique et non comparative
(étude ARRAY-818-202, PHAROS). Les patients devaient avoir un CBNPC
métastatique confirmé histologiquement avec une mutation BRAF V600E, un indice
de performance ECOG de 0 ou 1 et une maladie mesurable.
Les
patients étaient naïfs de traitement ou avaient reçu 1 ligne de traitement
systémique antérieur dans le cadre de leur maladie métastatique.
L'utilisation
antérieure d'inhibiteurs de BRAF ou d'inhibiteurs de MEK était interdite.
Les patients ont été recrutés sur la base de la détermination d'une mutation BRAF V600E dans le tissu tumoral ou le sang (par exemple, test génétique ADNct) par un test de laboratoire local. La confirmation centrale du statut de mutation BRAF V600E (c'est-à-dire toute variante courte avec un effet protéique V600E) a été réalisée sur des tissus tumoraux frais ou d'archives prélevés lors de l'inscription et a utilisé le test FoundationOne CDx - F1CDx (tissus).
La sensibilité analytique a été évaluée par l'étude de limite de détection (LoD) pour F1CDx en utilisant la méthode du taux de réussite (définie comme le niveau le plus bas avec une détection ≥ 95 %) en évaluant la fréquence allélique variable (FAV) pour les variants courts. Pour F1CDx, la LoD médiane de substitution a été déterminée à 3,2 % de FAV.
Au total, 98 patients ont été inclus et traités par binimetinib 45 mg par voie orale deux fois par jour et par encorafenib 450 mg par voie orale une fois par jour. Le traitement s'est poursuivi jusqu'à progression de la maladie ou toxicité inacceptable.
Le principal critère d'évaluation de l'efficacité était le taux de réponse objective (TRO) selon RECIST v1.1, tel qu'évalué par une revue radiologique indépendante (IRR). Les critères d'évaluation secondaires comprenaient la durée de réponse (DoR), le taux de contrôle de la maladie (TCM), la survie sans progression (SSP) et la survie globale (SG). Les résultats de l'analyse primaire avec 18,2 mois pour les patients naïfs de traitement et 12,8 mois pour les patients pré-traités sont présentés ci-dessous.
Sur les 98 patients inclus dans cette étude, 59 (60,2 %) étaient naïfs de traitement. L'âge médian des patients était de 70 ans (47-86), 53 % étaient des femmes, 88 % étaient blancs et 30 % n'avaient jamais fumé. 74 % avaient un indice de performance (PS) ECOG de 1 à l'inclusion (67,8 % des participants avaient un PS 1 à l'inclusion dans la population naïve de traitement et 82,1 % dans la population pré- traitée). Tous les patients présentaient une maladie métastatique, parmi lesquels 8 % avaient des métastases cérébrales au diagnostic et 97 % avaient un adénocarcinome.
Au moment de l'analyse principale, la durée médiane d'exposition était de 15,1 mois chez les patients naïfs de traitement et de 5,4 mois chez les patients préalablement traités. Dans la population globale, l'intensité de dose relative (IDR) médiane était de 95,4 % pour le binimetinib et de 99,2 % pour l'encorafenib.
Au moment de l'analyse principale, le critère d'évaluation principal du TRO évalué par IRR dans la population naïve de traitement était de 74,6 % (IC à 95 % : 61,6 ; 85,0), dont 9 (15,3 %) réponse complète (RC) et 35 (59,3 %) réponse partielle (RP).
Le TRO par IRR dans la population pré-traitée était de 46,2 % (IC à 95 % : 30,1, 62,8), dont 4 (10,3%) RC et 14 (35,9 %) RP.
Les résultats mis à jour avec un suivi supplémentaire de 10 mois (durée médiane d'exposition de 16,3 mois chez les patients naïfs de traitement et de 5,5 mois chez les patients préalablement traités) sont présentés dans le Tableau 9.
Tableau 9. Etude ARRAY-818-202 : Résultats d'efficacité
| Encorafenib avec Binimetinib | ||
|
Naïf
de traitement
(N = 59) |
Pré-traités
(N = 39) |
|
| TRO par IRR | ||
| TRO, % (95 % IC) | 75 % (62, 85) | 46 % (30, 63) |
| RC, % | 15 % | 10 % |
| RP, % | 59 % | 36 % |
| DoR par IRR | N = 44 | N = 18 |
| DoR médianne, mois (95 % IC) | 40.0 (23.1, NE) | 16.7 (7.4, NE) |
| % avec DoR ≥ 12 mois | 64 % | 44 % |
*
Les résultats d'une analyse de sensibilité considérant le nouveau traitement
anticancéreux comme un événement en plus de la progression et du décès sont de
23,1 mois chez les patients naïfs de traitement (14,8 ; NE) et de 12,0 mois
(6,3 ; NE) chez les patients précédemment traités.
N = nombre de patients ; TRO = Taux de réponse objective ; IC = Intervalle de Confiance ; RC = Réponse complète ; RP = Réponse partielle ; DoR = Durée de la réponse ; IRR = Revue Radiologique Indépendante ; NE = non évaluable ; SSP = Survie sans progression ; SG = Survie globale
N = nombre de patients ; TRO = Taux de réponse objective ; IC = Intervalle de Confiance ; RC = Réponse complète ; RP = Réponse partielle ; DoR = Durée de la réponse ; IRR = Revue Radiologique Indépendante ; NE = non évaluable ; SSP = Survie sans progression ; SG = Survie globale
Électrophysiologie cardiaque
Dans
l'analyse de tolérance des études poolées,
l'incidence de l'apparition d'un allongement de l'intervalle QTcF > 500 ms était de 1,1 % (4/363) dans l'ISP Combo
450 (n = 372) et de 2,5 % (5/203) dans le groupe de patients atteints de
mélanome traité en monothérapie par de l'encorafenib).
Un allongement de l'intervalle QTcF > 60 ms
comparé aux valeurs avant traitement a été observé chez 6,0 % des patients
(22/364) dans l'ISP Combo450 et chez 3,4 % (7/204) dans le groupe encorafenib utilisé seul (voir les rubriques Posologie
et mode d'administration et Mises en garde spéciales et précautions
d'emploi).
Dans l'analyse de tolérance de l'étude en phase 3 (ARRAY-818-302) dans l'indication CCR, l'incidence d'un nouvel allongement de l'intervalle QTcF > 500 ms était de 3,2 % (7/216). Un allongement de l'intervalle QTcF > 60 ms comparé aux valeurs avant traitement a été observé chez 8,8 % des patients (19/216) dans le groupe encorafenib + cetuximab (voir rubriques Posologie et mode d'administration et Mises en garde spéciales et précautions d'emploi).
Population pédiatrique
L'Agence européenne des médicaments a différé l'obligation de soumettre les résultats d'études réalisées avec l'encorafenib dans un ou plusieurs sous-groupes de la population pédiatrique dans le mélanome (voir rubrique Posologie et mode d'administration pour les informations concernant l'usage pédiatrique).
L'Agence européenne des médicaments a accordé une dérogation à l'obligation de soumettre les résultats d'études avec encorafenib dans tous les sous-groupes de la population pédiatrique dans lecancer colorectal et du cancer du poumon (voir rubrique Posologie et mode d'administration - Population pédiatrique).
La pharmacocinétique de l'encorafenib a été étudiée chez des sujets sains et chez des patients présentant des tumeurs solides,. La pharmacocinétique de l'encorafenib s'est révélée approximativement linéaire par rapport à la dose après des doses uniques et multiples. Après une dose quotidienne unique répétée, l'état d'équilibre a été atteint dans un délai de 15 jours. Le facteur d'accumulation d'environ 0,5 est probablement dû à l'auto-induction du CYP3A4. La variabilité interindividuelle (CV en %) de l'ASC est comprise entre 12,3 % et 68,9 %.
Absorption
Après l'administration orale, l'encorafenib est rapidement absorbé avec un Tmax médian de 1,5 à 2 heures. Après une dose orale unique de 100 mg [14C] d'encorafenib chez des sujets sains, au moins 86 % de la dose d'encorafenib ont été absorbés. L'administration d'une dose unique de 100 mg d'encorafenib avec un repas riche en matières grasses et en calories a fait baisser la Cmax de 36 %, alors que l'ASC n'a pas changé. Une étude d'interaction médicamenteuse réalisée chez des sujets sains a indiqué que l'ampleur de l'exposition à l'encorafenib n'était pas altérée en présence d'un agent modifiant le pH gastrique (rabéprazole).
Distribution
L'encorafenib est modérément lié (86,1 %) aux protéines plasmatiques humaines in vitro. Après une dose orale unique de 100 mg [14C]
d'encorafenib chez des sujets sains, le rapport de concentration
sang-plasma moyen (ET) est de 0,58 (0,02) et le volume apparent de
distribution (Vz/F) moyen (CV en %) de l'encorafenib est de 226 l (32,7 %).
Biotransformation
Après une dose orale unique de 100 mg [14C]
d'encorafenib chez des sujets sains, le métabolisme s'est révélé la
principale voie de la clairance pour l'encorafenib (environ 88 % de la
dose radioactive récupérée). La principale réaction de
biotransformation de l'encorafenib était la N-désalkylation.
D'autres
voies métaboliques majeures ont impliqué l'hydroxylation, l'hydrolyse
de carbamates, la glycurono-conjugaison indirecte et la formation de
conjugués au glucose.
Élimination
Après une dose orale unique de 100 mg [14C] d'encorafenib chez des sujets sains, la radioactivité a été éliminée équitablement à la fois dans les selles et dans l'urine (moyenne de 47,2 %). Dans l'urine, 1,8 % de la radioactivité a été excrétée sous forme d'encorafenib. La clairance apparente (CL/F) moyenne (CV en %) d'encorafenib était de 27,9 l/h (9,15 %). La demi-vie terminale (T1/2) d'encorafenib médiane (min-max) était de 6,32 h (3,74 à 8,09 h).
Interactions médicamenteuses
Aucune interaction médicamenteuse n'a été mise en évidence entre l'encorafenib et le cetuximab.
Effet des enzymes CYP sur l'encorafenib
L'encorafenib est métabolisé par CYP3A4, CYP2C19 et CYP2D6. In vitro,
il était attendu que CYP3A4 soit la principale enzyme contribuant à la
clairance oxydative totale de l'encorafenib dans les microsomes
hépatiques humains (~83,3 %), suivie par CYP2C19 et CYP2D6
(respectivement,~16,0 % et 0,71 %).
L'effet
de la co-administration d'un inducteur puissant du CYP3A4 sur
l'exposition à l'encorafenib n'a pas été étudiée dans le cadre d'un
essai dédié. L'administration de doses répétées d'encorafenib 450 mg
une fois par jour et de binimetinib 45 mg deux fois par jour chez des
patients atteints de mélanome traités par le modafinil, un inducteur
modéré du CYP3A4, a diminué l'ASC à l'état d'équilibre de l'encorafenib
de 24 % et la Cmax de 20 %, par rapport à l'encorafenib seul.
Effet de l'encorafenib sur les substrats de CYP
Des expériences in vitro démontrent
que l'encorafenib est un inhibiteur réversible relativement puissant
des UGT1A1, CYP2B6, CYP2C9 et CYP3A4/5, ainsi qu'un inhibiteur
temps-dépendant des CYP3A4. L'encorafenib a activé les CYP1A2, CYP2B6,
CYP2C9 and CYP3A4 dans les cultures primaires d'hépatocytes humains.
L'administration
de doses répétées d'encorafenib 450 mg une fois par jour et de
binimetinib 45 mg deux fois par jour chez des patients atteints de
mélanome avec une dose unique d'un cocktail de substrats sondes des CYP
a réduit l'ASC du midazolam 2 mg (substrat du CYP3A4) de 82 % et la
Cmax de 74 %. Cela a diminué l'ASC d'oméprazole 20 mg (substrat du
CYP2C19) de 17 % et n'a pas modifié la Cmax et a augmenté l'ASC de la
caféine 50 mg (substrat du CYP1A2) de 27 % et la Cmax de 13 %. Cela a
diminué de 28 % le rapport entre les concentrations du métabolite du
losartan E3174 et celles du losartan (substrat du CYP2C9) dans l'urine
et n'a pas modifié le rapport entre les concentrations du métabolite du
dextrométhorphane (dextrorphane) et celles du dextrométhorphane (substrat
du CYP2D6) dans l'urine. Ces résultats indiquent une forte induction du
CYP3A4, une légère inhibition du CYP1A2 et aucun impact sur la
pharmacocinétique des substrats du CYP2C19. À partir des données
urinaires, le pouvoir inhibiteur du CYP2C9 et du CYP2D6 ne peut être
définitivement conclu. Aucune donnée n'est disponible pour les
métaboliseurs lents du CYP2D6.
Une
dose unique d'encorafenib 450 mg et de binimetinib 45 mg a réduit l'ASC
et la Cmax du bupropion 75 mg (substrat du CYP2B6) de ≤
25 %. L'administration répétée d'encorafenib 450 mg par jour et de
binimetinib 45 mg deux fois par jour a réduit l'ASC et la Cmax du
bupropion de ≤ 26 % et a augmenté l'ASC du métabolite actif hydroxybupropion de 49 %, indiquant une légère induction.
Concernant l'administration concomitante avec les substrats de UGT1A1 qui subissent une extraction intestinale, une interaction mineure à modérée est attendue. Même si le binimetinib est un substrat de l'UGT1A1, il ne subit pas d'extraction intestinale et, par conséquent, aucune interaction médicamenteuse avec l'encorafenib n'est attendue. En outre, aucune différence au niveau de l'exposition n'a été observée du point de vue clinique lors de l'administration concomitante de binimetinib et d'encorafenib.
Effet des transporteurs sur l'encorafenib
On
a découvert que l'encorafenib était un substrat de la P-glycoprotéine
(P-gp), un transporteur membranaire. Il est peu probable que
l'inhibition de la P-gp engendre une augmentation importante d'un point
de vue clinique des concentrations d'encorafenib puisque l'encorafenib
présente une perméabilité intrinsèque élevée. Des études in vitro sur
l'implication de plusieurs familles de transporteurs qui contribuent à
l'absorption (OCT1, OATP1B1, OATP1B3 and OATPB1) ont été réalisées à
l'aide d'inhibiteurs des transporteurs concernés. Les données indiquent
que les transporteurs hépatiques contribuant à l'absorption ne sont pas
impliqués dans la distribution de l'encorafenib dans les cultures
primaires d'hépatocytes humains.
Effet de l'encorafenib sur les transporteurs
L'administration
répétée d'encorafenib à 450 mg une fois par jour et de binimetinib à 45
mg deux fois par jour avec une dose unique de rosuvastatine (un
substrat d'OATP1B1, OATP1B3 et BCRP) a augmenté la Cmax de la
rosuvastatine de 2,7 fois et l'ASC de 1,6 fois, indiquant une légère
inhibition des transporteurs OATP1B1, OATP1B3 et/ou BCRP.
In vitro,
l'encorafenib a inhibé le transporteur hépatique OCT1, mais il est peu
probable qu'il soit un inhibiteur cliniquement efficace. Selon des
études réalisées in vitro,
il est possible que l'encorafenib inhibe les transporteurs rénaux OCT2,
OAT1, OAT3 à des concentrations cliniques. De plus, il se peut que
l'encorafenib inhibe P-gp dans les intestins aux concentrations
cliniques attendues.
Populations spéciales
Âge
Selon
une analyse pharmacocinétique de population, il s'est avéré que l'âge
était une covariable significative sur le volume de distribution de
l'encorafenib, mais avec une grande variabilité. Étant donné la faible
amplitude de ces changements et la grande variabilité, ces résultats ne
sont probablement pas significatifs du point de vue clinique et aucun
ajustement de dose n'est nécessaire chez les personnes âgées.
Sexe
Selon
une analyse pharmacocinétique de population, le sexe n'apparaît pas
comme étant une covariable importante sur la clairance ou le volume de
distribution. Par conséquent, aucun changement majeur au niveau de
l'exposition à l'encorafenib n'est attendu en fonction du sexe.
Poids corporel
Selon
une analyse pharmacocinétique de population, il s'avère que le poids
corporel est une covariable importante sur la clairance et le volume de
distribution. Cependant, étant donné la faible amplitude du changement
au niveau de la clairance et la grande variabilité du volume de
distribution prédit dans le modèle, il est peu probable que le poids
ait une influence considérable du point de vue clinique sur
l'exposition de l'encorafenib.
Race
Il
n'existe pas de différences cliniquement pertinentes de
pharmacocinétique de l'encorafenib entre les patients asiatiques et les
patients non asiatiques. Les données ne sont pas suffisantes pour
évaluer les différences éventuelles au niveau de l'exposition de
l'encorafenib dans d'autres races ou origines ethniques.
Insuffisance hépatique
Les
résultats provenant d'un essai clinique spécifique indiquent des
expositions totales de l'encorafenib 25 % plus élevées chez les
patients atteints d'une insuffisance hépatique légère (classe A de
Child-Pugh) comparés aux sujets dont la fonction hépatique est normale.
Ceci se traduit par une augmentation de 55 % de l'exposition à
l'encorafenib libre.
La pharmacocinétique de l'encorafenib n'a pas été évaluée sur le plan clinique chez les patients atteints d'une insuffisance hépatique modérée (classe B de Child-Pugh) à sévère (classe C de Child- Pugh). Comme l'encorafenib est principalement métabolisé et éliminé par le foie, selon le modèle pharmacocinétique physiologique, les patients atteints d'une insuffisance hépatique modérée à sévère peuvent être confrontés à des augmentations plus importantes de l'exposition que les patients atteints d'une insuffisance hépatique légère. Il n'est pas possible de recommander une dose chez les patients atteints d'insuffisance hépatique modérée ou sévère (voir rubriques Posologie et mode d'administration et Mises en garde spéciales et précautions d'emploi).
Insuffisance rénale
L'élimination
rénale de l'encorafenib est minime. Aucune étude clinique officielle
n'a été menée pour évaluer l'effet de l'insuffisance rénale sur la
pharmacocinétique de l'encorafenib.
Dans une analyse pharmacocinétique de population, aucune tendance évidente au niveau de la CL/F de l'encorafenib n'a été observée chez les patients présentant une insuffisance rénale minime (eDFGe de 60 à 90 ml/min/1,73 m2) ou modérée (DFGe de 30 à 59 ml/min/1,73 m2) comparés aux sujets dont la fonction rénale est normale (DFGe ≥ 90 ml/min/1,73 m2). Une légère baisse de la CL/F (≤ 5 %) a été prédite chez les patients présentant une insuffisance rénale légère et modérée, ce qui n'est probablement pas significatif du point de vue clinique. La pharmacocinétique de l'encorafenib n'a pas été étudiée chez les patients présentant une insuffisance rénale sévère.
L'encorafenib a une influence mineure sur l'aptitude à conduire des véhicules ou à utiliser des machines. Des troubles de la vision ont été rapportés chez certains patients traités par l'encorafenib pendant les essais cliniques. Il faut recommander aux patients de ne pas conduire de véhicules ou d'utiliser de machines en cas de troubles de la vision ou de tout autre effet indésirable qui pourrait nuire à leur aptitude à conduire des véhicules ou à utiliser des machines (voir rubriques Mises en garde spéciales et précautions d'emploi et Effets indésirables).
Dans les études sur de toxicité chez le rat d'une durée de 4 et 13 semaines, des signes cliniques, une diminution du poids corporel, une diminution du poids des épididymes et de la prostate et des anomalies microscopiques au niveau des testicules, des épididymes, de l'estomac et de la peau ont été constatés. Une réversibilité partielle de ces anomalies a été observée après une période de récupération de 4 semaines. Aucune dose sans effet nocif observable (NOAEL) n'a pu être établie pour l'étude de 4 semaines. La dose sans effet nocif observable (NOAEL) déterminée dans l'étude de 13 semaines était plus de 10 fois l'exposition à la dose thérapeutique chez l'Homme.
Dans l'étude de toxicité chez le singe d'une durée de 4 et 13 semaines, des épisodes isolés/sporadiques de vomissements et de diarrhée ainsi que des lésions ophtalmiques ont été observés à un niveau légèrement supérieur à l'exposition à la dose thérapeutique chez l'Homme. Les lésions ophtalmiques étaient partiellement réversibles et consistaient en une séparation ou un décollement au niveau de la rétine entre la couche externe constituée par les bâtonnets et les cônes et l'épithélium pigmentaire de la rétine au niveau de la zone centrale de la macula, dans la fovéa.. Cette observation était semblable à celle décrite chez les Hommes sous les termes de choriorétinopathie de type séreuse centrale ou rétinopathie séreuse centrale.
L'encorafenib ne s'est pas révélé génotoxique.
Aucune
étude évaluant la fertilité n'a été réalisée avec l'encorafenib. Dans
l'étude de toxicité d'une durée de 13 semaines, effectuée chez le rat,
le traitement par encorafenib à une dose de 6 mg/kg/j (niveau de dose
équivalant à plus de 5 fois l'exposition humaine à la dose
thérapeutique) a entraîné une diminution du poids des testicules et des
épididymes, accompagnée d'une dégénérescence tubulaire et d'une
oligospermie. Dans l'étude d'une durée de 13 semaines, une
réversibilité partielle a été observée au niveau de dose le plus élevé
(60 mg/kg/j).
L'étude
sur le développement embryofœtal menée chez les rats a indiqué que
l'encorafenib induisait une toxicité fœtale avec des fœtus de poids
moins élevés et des retards de développement du squelette. L'étude sur
le développement embryofœtal menée chez les lapins a indiqué que
l'encorafenib induisait une toxicité fœtale avec des fœtus de poids
moins élevés et des changements temporaires au niveau du développement
du squelette. Une dilatation de l'arc aortique a été observée chez
certains fœtus.
L'encorafenib s'est révélé phototoxique lors du test de phototoxicité in vitro 3T3 NRU. L'encorafenib ne s'est pas révélé sensibilisant lors du test de sensibilisation in vivo réalisé chez la souris. L'ensemble de ces données indiquent que l'encorafenib présente un risque de potentiel phototoxique et un risque minime de sensibilisation aux doses thérapeutiques pour les patients.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I.
Médicament nécessitant une surveillance particulière pendant le traitement.
Prescription hospitalière.
Prescription réservée aux médicins compétents en CANCEROLOGIE.
Prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE.
Médicament nécessitant une surveillance particulière pendant le traitement.
Prescription hospitalière.
Prescription réservée aux médicins compétents en CANCEROLOGIE.
Prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE.
Remboursement en fonction de l'indication (JO du 22/08/2019) :
La seule indication thérapeutique ouvrant droit à la prise en charge ou au remboursement par l'assurance maladie est le traitement en association avec le binimetinib de patients adultes atteints de mélanome non résécable ou métastatique porteur d'une mutation BRAF V600.
Extension d'indication (JO du 08/03/2022) :
La prise en charge de la spécialité ci-dessous est étendue à l'indication suivante :
- en association au cetuximab, dans le traitement de patients adultes
atteints de cancer colorectal (CCR) métastatique porteur d'une mutation
BRAF V600E, ayant reçu un traitement systémique antérieur.
Gélule.
Coiffe
de couleur chair opaque et corps blanc opaque, comportant un « A »
stylisé, imprimé sur la coiffe et la mention « LGX 75mg » sur le corps.
La gélule mesure environ 23 mm de long.
Chaque boîte contient 42x1 gélules sous plaquettes thermoformées en dose unique en polyamide/aluminium/PVC/aluminium/PET/papier.
Chaque gélule contient 75 mg d'encorafenib.
Pour la liste complète des excipients, voir rubrique Liste des excipients.
Contenu de la gélule
Copovidone (E1208)
Poloxamer 188
Cellulose microcristalline (E460i)
Acide succinique (E363)
Crospovidone (E1202)
Silice colloïdale anhydre (E551)
Stéarate de magnésium (E470b)
Enveloppe de la gélule
Gélatine (E441)
Dioxyde de titane (E171)
Oxyde de fer rouge (E172)
Oxyde de fer jaune (E172)
Oxyde de fer noir (E172)
Encre de marquage
Laque (E904)
Oxyde de fer noir (E172)
Propylène glycol (E1520)